Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 48, trong đó số hạt mang điện gấp đôi số hạt không mang điện. Nguyên tố Y là
A. sodium (Na).
B. calcium Ca).
C. boron (B).
D. magnesium (Mg).
 Giải bởi qa.haylamdo.com
Giải bởi qa.haylamdo.com
Đáp án đúng là: D
Nguyên tử Y gồm 3 hạt cơ bản là proton (p) mang điện tích dương, neutron (n) không mang điện và electron (e) mang điện tích âm.
Trong đó: số p = số e.
Nguyên tử nguyên tố Y có tổng số hạt cơ bản là 48.
2p + n = 48 (*).
Số hạt mang điện gấp đôi số hạt không mang điện: 2p = 2n p = n (**).
Từ (*) và (**), ta có: p = 12, n = 12.
Số hiệu nguyên tử Z = số p = 12 Y là nguyên tố magnesium (Mg).
Nguyên tử nguyên tố magnesium có 3 lớp electron, trong đó lớp ngoài cùng có 2 electron. Số proton trong nguyên tử magnesium là
Khu vực không gian xung quanh hạt nhân nguyên tử mà xác xuất tìm thấy electron ở khu vực đó là lớn nhất (khoảng 90%) gọi là
Theo mô hình nguyên tử Rutherford – Bohr, electron thuộc lớp nào sau đây có năng lượng thấp nhất?
Mô hình nguyên tử theo Rutherford – Bohr không có nội dung nào sau đây?
Sự khác biệt cơ bản giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử là
Cho mô hình nguyên tử của nguyên tố nitrogen (N) như sau:
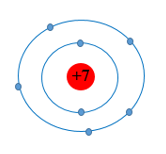
Số proton và số electron lớp ngoài cùng của nguyên tử N lần lượt là
Cho cấu trúc nguyên tử aluminium theo mô hình Rutherford – Bohr như sau:
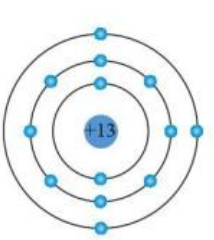
Lớp ngoài cùng của nguyên tử aluminium có bao nhiêu electron?
Phát biểu nào sau đây là đúng khi nói về hình dạng của orbital nguyên tử?
Nguyên tử nguyên tố X có 8 neutron và có số khối là 16. Lớp ngoài cùng của nguyên tử X có