Kí hiệu và đơn vị của tốc độ phản ứng là
A. kí hiệu là 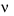 , đơn vị là (đơn vị nồng độ) / đơn vị thời gian;
, đơn vị là (đơn vị nồng độ) / đơn vị thời gian;
B. kí hiệu là  , đơn vị là (đơn vị khối lượng) / đơn vị thời gian;
, đơn vị là (đơn vị khối lượng) / đơn vị thời gian;
C. kí hiệu là 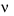 , đơn vị là (đơn vị nồng độ) / đơn vị thể tích;
, đơn vị là (đơn vị nồng độ) / đơn vị thể tích;
D. kí hiệu là  , đơn vị là (đơn vị khối lượng) / đơn vị thể tích.
, đơn vị là (đơn vị khối lượng) / đơn vị thể tích.
 Giải bởi qa.haylamdo.com
Giải bởi qa.haylamdo.com
Đáp án đúng là: A
Tốc độ phản ứng kí hiệu là 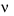 , đơn vị là (đơn vị nồng độ) / đơn vị thời gian.
, đơn vị là (đơn vị nồng độ) / đơn vị thời gian.
Cho phản ứng đơn giản xảy ra trong bình kín: 2CO (g) + O2 (g) ⟶ 2CO2 (g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 2 lần, nồng độ O2 không đổi.
Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
Cho phản ứng: 2H2O2 (aq) O2 (s) +2H2O (l)
O2 (s) +2H2O (l)
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 3 lần.
Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2 (g) ⟶ 2HCl (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần.
Cho phản ứng: 2SO2 (g) + O2 (g) 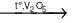 2SO3 (g)
2SO3 (g)
Biểu thức tốc độ thức thời của phản ứng theo định luật tác dụng khối lượng là
Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
Cho phản ứng:
2N2O5 (g) ⟶ O2 (g) + 4NO2 (g)
Sau thời gian từ giây 57 đến giây 116, nồng độ N2O5 giảm từ 0,4 M về 0,35 M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
Cho phản ứng: Br2 (l) + HCOOH (aq) 2HBr (aq) + CO2 (s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5M/s. Giá trị của a là