Cho dung dịch A chứa các ion K+(0,01 mol), M+, SO42-, CO32-. Cho dung dịch A tác dụng với BaCl2dư thu được 8,96 gam kết tủa. Mặt khác cho dung dịch A tác dụng với H2SO4loãng dư thu được 0,224 lít khí (đktc). Khi cô cạn dung dịch A thu được 5,48 gam muối khan. Tìm ion M+( biết M+không kết tủa với ion Cl-).
 Giải bởi qa.haylamdo.com
Giải bởi qa.haylamdo.com
Gọi số mol của M+, SO42-, CO32-lần lượt là x, a, b.
Cho A + BaCl2 dư ta thấy xảy ra phản ứng:
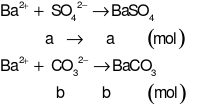
⇒ 233a + 197b = 8,96 (1)
Khi cho A + H2SO4loãng, dư ta có phản ứng:
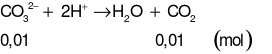
⇒ b = 0,01 (mol) thay vào (1) được a = 0,03 (mol)
Áp dụng định luật bảo toàn điện tích cho dung dịch A ta có:
Tổng số mol điện tích dương = tổng số mol điện tích âm
⇒ 0,01 + x = 0,03.2 + 0,01.2
⇒ x = 0,07
Mặt khác, cô cạn dung dịch A thu được 5,48g muối khan nên ta có:
mmuối= 0,01.39 + (MM+). 0,07 + 96.0,03 + 60.0,01 = 5,48
⇒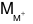 = 23. Vậy M là Na.
= 23. Vậy M là Na.
Dung dịch Ba(OH)20,005M (coi Ba(OH)2điện li hoàn toàn 2 nấc) có pH là
Người ta sản xuất khí nitơ trong công nghiệp bằng cách nào sau đây?
Cho Cu tác dụng với dung dịch HNO3loãng ra khí A không màu hóa nâu. Khí A là
Dãy ion nào sau đây có thể tồn tại đồng thời trong cùng một dung dịch:
Cho phản ứng: Ag + HNO3 AgNO3+ NO2+ H2O. Tổng hệ số tối giản các chất tham gia trong phương trình khi cân bằng là
Dãy gồm các ion (không kể đến sự phân li của nước) cùng tồn tại trong một dung dịch là:
Phương trình phản ứng: BaCl2+ Na2SO4 BaSO4+ 2NaCl. Có phương trình ion thu gọn là