Đề thi Hóa 11 giữa kì 1 có đáp án (Đề 4)
-
1473 lượt thi
-
32 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Nhiệt phân hoàn toàn KNO3thu được sản phẩm gồm:
Đáp án B
Phương trình phản ứng:
2KNO3 2KNO2+ O2
2KNO2+ O2
Câu 2:
Phản ứng nào sau đây không phải phản ứng trao đổi ion?
Đáp án D
Phản ứng Mg + 2AgNO3 Mg(NO3)2 + 2Ag là phản ứng oxi hoá – khử do có sự thay đổi số oxi hoá của các nguyên tố Mg và Ag trước và sau phản ứng.
Câu 3:
Cho các chất sau: Zn, Na2CO3, Cu(OH)2, Mg, NH3. Số chất tác dụng được với dung dịch HNO3là
Đáp án B
3Zn + 8HNO3 3Zn(NO3)2 + 2NO + 4H2O
Na2CO3 + 2HNO3 2NaNO3 + CO2 + H2O
Cu(OH)2+ 2HNO3 Cu(NO3)2 + 2H2O
4Mg + 10HNO3 4Mg(NO3)2 + N2O + 5H2O
NH3 + HNO3 NH4NO3
Câu 4:
Một dung dịch có [H+] = 10-5. Môi trường của dung dịch này là
Đáp án C
pH= -log[H+]=-log 10-5 = 5
pH< 7 Dung dịch có môi trường axit.
Câu 5:
Dung dịch chất nào sau đây có pH nhỏ?
Đáp án A
pH càng nhỏ khi dung dịch có tính axit càng mạnh.
HCl là axit
NaOH là bazơ
K2SO4, NaCl là muối trung tính.
Câu 6:
Dãy nào dưới đây chỉ gồm chất điện li mạnh?
Đáp án A
Hầu hết các muối, axit mạnh, bazơ mạnh là các chất điện li mạnh.
Đáp án B, loại Fe(OH)2vì là bazơ yếu
Đáp án C, loại HF vì là axit yếu.
Đáp án D, loại CH3COOH vì là axit yếu.
Câu 7:
Trong dung dịch NaCl 0,01 M. Nồng độ các ion:
Đáp án C
NaCl là chất điện li mạnh, trong dung dịch phân li hoàn toàn ra ion.
NaCl Na+ + Cl-
⇒ [Na+] = [Cl-]
Câu 8:
Cho Cu tác dụng với dung dịch HNO3loãng ra khí A không màu hóa nâu. Khí A là
Đáp án C
3Cu + 8HNO3→ 3Cu(NO3)2+ 2NO + 4H2O
2NO(không màu)+ O22NO2(nâu đỏ)
Câu 9:
Cho phản ứng: Ag + HNO3 AgNO3+ NO2+ H2O. Tổng hệ số tối giản các chất tham gia trong phương trình khi cân bằng là
Đáp ánC
Ag +2HNO3 AgNO3+ NO2+ H2O
Tổng hệ số tối giản các chất tham gia = 1+ 2 = 3.
Câu 10:
Chất nào sau đây là muối axit?
Đáp án D
Muối axit là muối khi tan trong nước có khả năng phân li ra ion H+.
KHSO4 K+ + HSO4-
HSO4- H+ + SO42-
Câu 11:
Dãy gồm các ion (không kể đến sự phân li của nước) cùng tồn tại trong một dung dịch là:
Đáp án D
Các ion cùng tồn tại trong 1 dung dịch khi chúng không phản ứng với nhau.
4 ionH+, Al3+, NO3−, SO42−không phản ứng với nhau nên có thể cùng tồn tại trong 1 dung dịch.
Dãy A loại vì: Ag++ Cl-→ AgCl↓
Dãy B loại vì: Al3++ 3OH-→ Al(OH)3↓
NH4++ OH-→ NH3↑ + H2O
Dãy C loại vì: Ba2++ SO42-→ BaSO4↓
3Ba2++ 2PO43-→ Ba3(PO4)2↓
Câu 12:
Dãy ion nào sau đây có thể tồn tại đồng thời trong cùng một dung dịch:
Đáp án B
Các ion cùng tồn tại trong 1 dung dịch khi chúng không phản ứng với nhau.
4 ion Na+, K+, Cl-, OH-không phản ứng với nhau nên có thể cùng tồn tại trong 1 dung dịch.
Câu 14:
Phương trình phản ứng: BaCl2+ Na2SO4 BaSO4+ 2NaCl. Có phương trình ion thu gọn là
Đáp án C
BaCl2 Ba2+ + 2Cl-
Na2SO4 2Na+ + SO42-
Phương trình ion thu gọn: Ba2+ + SO42- BaSO4¯
Câu 15:
Phương trình điện li nào dưới đây viết không đúng ?
Đáp án D
CH3COOH là 1 axit yếu, là chất điện li yếu. Phương trình điện li:
CH3COOH ⇄ CH3COO-+ H+
Câu 16:
Phản ứng nào chứng tỏ NH3có tính bazơ?
Đáp ánC
NH3phản ứng với axit HNO3tạo muối NH4NO3
NH3thể hiện tính bazơ.
Câu 18:
Người ta sản xuất khí nitơ trong công nghiệp bằng cách nào sau đây?
Đáp án D
Trong công nghiệp, nitơ được điều chế bằng cách chưng cất phân đoạn không khí lỏng.
Câu 19:
Khí nào có mùi khai và độc?
Đáp án A
NH3là chất khí, không màu, có mùi khai, tan tốt trong nước và có tính độc.
Câu 20:
Các cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch ?
Đáp án D
Loại A vì Fe3+ + 3OH- Fe(OH)3¯
Loại B vì H+ + F- HF
Loại C vì Ag+ + Cl- AgCl¯
Câu 21:
200 ml dung dịch Na2SO40,1M. Số mol của ion Na+và SO42-lần lượt là
Đáp án B
Số mol của dung dịch Na2SO4là n = CM.V = 0,1.0,2 = 0,02 mol
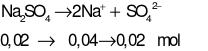
Vậy số mol của ion Na+và SO42-lần lượt là 0,04 và 0,02.
Câu 22:
Phương trình ion thu gọn của phản ứng cho biết:
Đáp án D
Phương trình ion thu gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 23:
Dung dịch Ba(OH)20,005M (coi Ba(OH)2điện li hoàn toàn 2 nấc) có pH là
Đáp án C
Nồng độ mol của Ba(OH)2có trong dung dịch là CM= 0,005M.
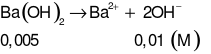
⇒ [OH-] = 0,01 ⇒ pH = 14 + log[OH-] = 14 - 2 = 12.
Câu 24:
Số oxi hóa của N trong NO là
Đáp án A
Trong NO, số oxi hóa của O là -2.
Áp dụng quy tắc, trong hợp chất, tổng số số oxi hóa của từng nguyên tố nhân với số nguyên tử bằng 0, suy ra số oxi hóa của N là + 2.
Câu 25:
Phản ứng của NH3dư với HCl tạo ra “khói trắng“, chất này có công thức hoá học là
Đáp án C
NH3 + HCl NH4Cl.
Câu 26:
Phân tử Nitơ gồm 2 nguyên tử Nitơ liên kết với nhau bằng
Đáp án D
Công thức cấu tạo của nitơ: N ≡ N
Vậy giữa hai nguyên tử nitơ trong phân tử nitơ có một liên kết ba.
Câu 27:
Muối (NH4)2CO3tác dụng được với dung dịch chất nào sau đây?
Đáp án A
(NH4)2CO3 + 2NaOH Na2CO3 + 2NH3 + 2H2O
Câu 28:
Chất nào sau đây là axit có tính oxi hoá mạnh?
Đáp án A
HNO3là axit có tính oxi hóa mạnh.
Câu 29:
Hoàn thành sơ đồ sau :
Zn Zn(NO3)2
Zn(NO3)2 ZnO
ZnO ZnCl2
ZnCl2 Zn(OH)2
Zn(OH)2
4Zn + 10HNO3 4Zn(NO3)2 + N2O + 5H2O
2Zn(NO3)2 2ZnO + 4NO2 + O2
ZnO + 2HCl ZnCl2 + H2O
ZnCl2 + 2NaOH Zn(OH)2↓ + 2NaCl.
Câu 30:
Hoàn thành phương trình phân tử và viết phương trình ion thu gọn của các phản ứng sau:
a. MgCl2 + NaOH →
b. HNO3 + KOH →
a. Phương trình phân tử: MgCl2+ 2NaOH → Mg(OH)2↓ + 2NaCl
Phương trình ion thu gọn: Mg2++ 2OH-→ Mg(OH)2↓
b. Phương trình phân tử: HNO3+ KOH → KNO3+ H2O
Phương trình ion thu gọn: H++ OH-→ H2O.
Câu 31:
Trộn các dung dịch HCl 0,75M, HNO30,15M; H2SO40,3M với các thể tích bằng nhau thì thu được dung dịch X. Trộn 150ml dung dịch X với 350ml dung dịch Ba(OH)20,1M thì thu được dung dịch Y có pH = x. Tìm x?
Để có 150 ml X thì mỗi dung dịch axit đều lấy 50 ml hay 0,05 lít.
Ta có:
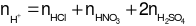 = 0,75.0,05 + 0,15.0,05 + 2.0,3.0,05 = 0,075 mol
= 0,75.0,05 + 0,15.0,05 + 2.0,3.0,05 = 0,075 mol
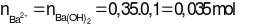
nOH-= 2.nBa2+= 0,035.2 = 0,07 mol
Phản ứng trung hòa:
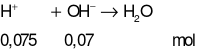
⇒ H+dư: 0,075 – 0,07 = 0,005 mol
⇒ [H+]dư=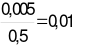
⇒ pH = -log[H+] = 2.
Câu 32:
Cho dung dịch A chứa các ion K+(0,01 mol), M+, SO42-, CO32-. Cho dung dịch A tác dụng với BaCl2dư thu được 8,96 gam kết tủa. Mặt khác cho dung dịch A tác dụng với H2SO4loãng dư thu được 0,224 lít khí (đktc). Khi cô cạn dung dịch A thu được 5,48 gam muối khan. Tìm ion M+( biết M+không kết tủa với ion Cl-).
Gọi số mol của M+, SO42-, CO32-lần lượt là x, a, b.
Cho A + BaCl2 dư ta thấy xảy ra phản ứng:
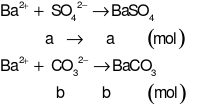
⇒ 233a + 197b = 8,96 (1)
Khi cho A + H2SO4loãng, dư ta có phản ứng:
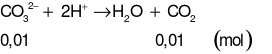
⇒ b = 0,01 (mol) thay vào (1) được a = 0,03 (mol)
Áp dụng định luật bảo toàn điện tích cho dung dịch A ta có:
Tổng số mol điện tích dương = tổng số mol điện tích âm
⇒ 0,01 + x = 0,03.2 + 0,01.2
⇒ x = 0,07
Mặt khác, cô cạn dung dịch A thu được 5,48g muối khan nên ta có:
mmuối= 0,01.39 + (MM+). 0,07 + 96.0,03 + 60.0,01 = 5,48
⇒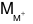 = 23. Vậy M là Na.
= 23. Vậy M là Na.