b. Một loại gas (khí hóa lỏng) chứa hỗn hợp propan (C3H8) và butan (C4H10) với tỉ lệ mol 1 : 2.
Cho biết giá trị ∆rHo298 (lượng chất tham gia phản ứng tính theo mol) của các phản ứng:
|
C3H8 (k) + O2 (k) → 3CO2 (k) + 4H2O (l) C4H10 (k) + O2 (k) → 4CO2 (k) + 5H2O (l) |
∆rHo298 = -2220 kJ ∆rHo298 = -2874 kJ |
Xác định lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 12 kg khí gas trên ở điều kiện chuẩn.
Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 10.000 kJ nhiệt (hiệu suất hấp thụ nhiệt là 80%). Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg?
 Giải bởi qa.haylamdo.com
Giải bởi qa.haylamdo.com
b.
-Tính được: = 75 mol, = 150 mol
-Lượng nhiệt: 75.(-2220) + 150.(-2874) = 597600 kJ
-Thời gian sử dụng là: = 47,8 ngày.
b. Viết các phương trình phản ứng theo sơ đồ chuyển hóa sau:
glucozơ → rượu etylic → axit axetic → etyl axetat
Đốt một lượng sắt trong oxi sau một thời gian thu được m gam chất rắn X gồm Fe, FeO, Fe2O3, Fe3O4. Hòa tan X vào 200 ml dung dịch H2SO4 1M đến phản ứng hoàn toàn thì thu được 1,12 lít khí H2, còn lại 2,8 gam kim loại chưa tan. Tính m.
b. Nung nóng đỏ R rồi dẫn hơi nước đi qua thì thu được hỗn hợp gồm khí Z và khí T (trong đó Z là khí độc). Ở nhiệt độ cao, Z và T đều khử được oxit sắt từ thành kim loại. Xác định công thức của Z, T và viết phương trình phản ứng xảy ra.
Cho m gam hỗn hợp các muối MgSO4, CuSO4 và BaSO4 trong đó lưu huỳnh chiếm 19,07% về khối lượng vào nước được dung dịch A và một phần không tan có khối lượng 9,32 gam. Nhúng thanh nhôm (dư) vào dung dịch A. Sau phản ứng khối lượng thanh kim loại tăng 4,14 gam. Tính m.
Nguyên tử của nguyên tố R có tổng số hạt proton, nơtron và electron là 18, trong đó số hạt mang điện gấp đôi số hạt không mang điện.
a. Xác định tên gọi của R.
Một học sinh làm thí nghiệm với ba chiếc đinh sắt có kích thước như nhau, chiếc thứ nhất để ngoài không khí, chiếc thứ 2 ngâm trong dầu hỏa (thành phần chính là các hiđrocacbon), chiếc thứ 3 ngâm trong dung dịch muối ăn.
Em hãy dự đoán thứ tự về tốc độ ăn mòn của ba chiếc đinh sắt và đề xuất biện pháp bảo vệ vật làm bằng sắt, thép đối với sự ăn mòn.
Biến thiên entanpi chuẩn của một phản ứng hóa học, kí hiệu là ∆rHo298, chính là nhiệt tỏa ra hay thu vào kèm theo phản ứng đó ở điều kiện chuẩn. Nếu giá trị ∆rHo298 < 0 thì phản ứng tỏa nhiệt, nếu giá trị ∆rHo298 > 0 thì phản ứng thu nhiệt. Khi các chất trong phản ứng đều là chất khí, có thể tính ∆rHo298 bằng cách lấy tổng năng lượng liên kết (Eb) của các chất phản ứng trừ đi tổng năng lượng liên kết (Eb) của các chất sản phẩm. Cho giá trị trung bình của một số năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C-H |
C-C |
C=C |
C≡C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
837 |
a. Tính giá trị ∆rHo298 cho phản ứng CH3-CH2-CH3 (k) → CH4 (k) + CH2=CH2 (k) và nhận định phản ứng tỏa nhiệt hay thu nhiệt? Biết các chất phản ứng và các sản phẩm đều ở thể khí.
Sơ đồ dưới đây mô tả thí nghiệm điều chế khí X từ đất đèn:
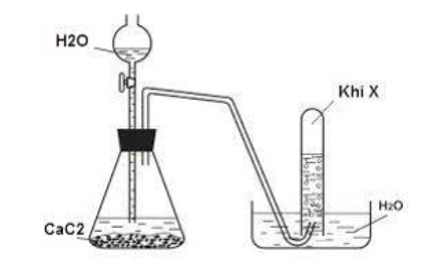
a. Xác định công thức cấu tạo, tên gọi của X, viết phương trình phản ứng điều chế trong thí nghiệm.
Hoà tan hỗn hợp A gồm các chất: Na2O, NaHCO3, NH4Cl, BaCl2 có số mol mỗi chất bằng nhau vào nước dư. Sau phản ứng, đun nóng để khí bay ra hết thu được khí X, dung dịch Y và kết tủa M. Xác định các chất tan trong Y và viết các phương trình phản ứng xảy ra.
b. Cho dung dịch KOH vào dung dịch FeSO4 rồi để ống nghiệm ngoài không khí.
Cho các chất rắn sau: BaSO4, CH3COONa, Ba(HSO3)2, NaHCO3.
a. Chất nào không thể điều chế bằng cách cho kiềm tác dụng với oxit axit?
b. Khí X có khả năng làm mất màu nước brom. Khi cháy trong oxi tỏa nhiều nhiệt nên được dùng để hàn, cắt kim loại. Viết phương trình phản ứng của X với dung dịch brom dư và phản ứng đốt cháy X.
Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các quá trình sau:
a. Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch Ba(OH)2 có nhỏ sẵn vài giọt phenolphtalein.
c. Chỉ dùng một thuốc thử, hãy phân biệt bốn chất trên bằng các phản ứng hóa học.