Hỗn hợp X gồm Al và một oxit sắt. Nung m gam X trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần:
- Cho phần 1 vào lượng dư dung dịch NaOH, thu được 1,68 lít khí và 12,6 gam chất rắn.
- Cho phần 2 vào dung dịch H2SO4 đặc (nóng, dư), thu được 27,72 lít khí SO2 và dung dịch Z có chứa 263,25 gam muối sunfat.
Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở đktc.
a. Viết phương trình hóa học của các phản ứng xảy ra.
 Giải bởi qa.haylamdo.com
Giải bởi qa.haylamdo.com
a. Phương trình hóa học của các phản ứng xảy ra:
2yAl + 3FexOy 3xFe + yAl2O3
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2Al + 6H2SO4(đ) Al2(SO4)3 + 3SO2 + 6H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
2Fe + 6H2SO4(đ) Fe2(SO4)3 + 3SO2 + 6H2O
2FexOy + (2x+2y)H2SO4(đ) xFe2(SO4)3 + (2y-x)SO2 + (2x+2y)H2O
Hòa tan hỗn hợp M gồm 0,4 mol Cu và 0,1 mol Fe3O4 trong 400 ml dung dịch HCl 2M. Sau phản ứng, thu được dung dịch A và chất rắn B. Cho A tác dụng với lượng dư dung dịch AgNO3 thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính m.
X là dung dịch HCl, Y là dung dịch NaOH. Cho 8,2 gam hỗn hợp G gồm Al, Fe vào cốc đựng 420 ml X. Sau phản ứng, thêm tiếp 800 gam Y vào cốc. Khuấy đều cho phản ứng xảy ra hoàn toàn, lọc kết tủa đem nung trong không khí đến khối lượng không đổi, thu được 6,55 gam chất rắn A.
Cho 120 ml X vào cốc chứa 200 gam Y thu được dung dịch Z chỉ chứa 1 chất tan. Cô cạn Z thu được 28,35 gam chất rắn T, cho toàn bộ T vào dung dịch AgNO3 dư thu được 43,05 gam kết tủa.
a. Tính nồng độ mol của X và nồng độ phần trăm của Y.
Hình vẽ bên mô tả cách điều chế và thu khí SO2 trong phòng thí nghiệm.
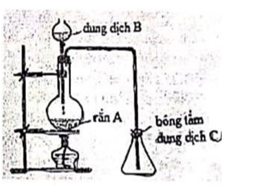
a. Xác định các chất A, B, C và viết phương trình phản ứng xảy ra giữa A và B.
Hỗn hợp X gồm hai este no, mạch hở. Cho X tác dụng với dung dịch NaOH vừa đủ, thu được hỗn hợp Z gồm 2 ancol (số nguyên tử cacbon trong mỗi phân tử ancol không vượt quá 3) và 12,3 gam muối của một axit cacboxylic (muối Y). Đốt cháy hoàn toàn Y thu được 7,95 gam Na2CO3. Mặt khác, đốt cháy hoàn toàn Z thu được 3,36 lít khí CO2 (đktc) và 4,32 gam H2O. Tính phần trăm khối lượng của este có khối lượng phân tử lớn hơn trong X.
d. Cho 2 hóa chất là dung dịch H2SO4 đặc và CaO rắn, hóa chất nào được dùng để làm khô khí SO2? Giải thích.
Nêu hiện tượng và viết phương trình phản ứng xảy ra trong các thí nghiệm sau:
a. Nhỏ từ từ đến dư dung dịch HCl vào dung dịch Na2CO3.
Cho 4 hợp chất hữu cơ mạch hở X, Y, Z, T có công thức phân tử là C2H2, C4H8, C2H6O, C2H4O2 nhưng không theo thứ tự. X, Y, Z, T có các tính chất sau:
- X tác dụng được với Na và dung dịch NaOH.
- Y, T làm mất màu nước brom.
- Z tác dụng với Na nhưng không tác dụng với dung dịch NaOH.
- T tác dụng với dung dịch AgNO3 trong NH3 (Ag2O/NH3) thu được kết tủa màu vàng.
Biết Y có cấu tạo đối xứng. Xác định công thức cấu tạo của X, Y, Z, T và viết các phương trình phản ứng xảy ra.
Hoàn thành các phương trình phản ứng theo sơ đồ sau (mỗi chữ cái trong ngoặc là một chất):
(A) → (B) + (C) + (D)
(C) + (E) → (G) + (H) + (I)
(A) + (E) → (K) + (G) + (I) + (H)
(K) + (H) → (L) + (I) + (M)
Biết: (D), (I), (M) là các đơn chất khí trong điều kiện thường; khí (I) có tỉ khối hơi so với khí SO2 là 1,1094; để trung hòa dung dịch chứa 2,24 gam (L) cần 200 ml dung dịch H2SO4 0,1M.