20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án ( Đề 1)
-
2012 lượt thi
-
41 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ có thể xảy ra khi
Câu 2:
Phần đạm urê thường chỉ chứa 46% N. Khối lượng (kg) urê đủ cung cấp 70 kg N là
Khối lượng ure cần để cung cấp 70 kg N là:
Chọn đáp án A.
Câu 3:
A là dẫn xuất benzen có công thức nguyên . 1 mol A cộng tối đa 4 mol H2 hoặc 1 mol Br2 (dung dịch). Vậy A là
Chọn đáp án C.
Câu 4:
Công thức cần tìm là: K2O.CaO.6SiO2
Chọn đáp án C.
Câu 5:
Ứng với công thức phân tử C4H8O2 có bao nhiêu este đồng phân của nhau?
HCOOCH2CH2CH3; HCOOCH(CH3)2; CH3COOCH2CH3; CH3CH2COOCH3
Chọn đáp án C.
Câu 6:
Si phản ứng với tất cả các chất trong dãy nào sau đây trong điều kiện thích hợp?
Si phản ứng với tất cả các chất trong dãy dưới đây trong điều kiện thích hợp: F2, Mg, NaOH.
Chọn đáp án B.
Câu 7:
Khi đốt 0,1 mol chất X (dẫn xuất của benzen), khối lượng CO2 thu được nhỏ hơn 35,2g. Biết 1 mol X chỉ tác dụng với 1 mol NaOH. Công thức cấu tạo thu gọn của X là
Số C
1 mol X tác dụng với 1 mol NaOH nên X là HOC6H4CH2OH.
Chọn đáp án C.
Câu 8:
Để chứng minh trong phân tử của glucozơ có nhiều nhóm hiđroxyl, người ta cho dung dịch glucozơ phản ứng với
Để chứng minh trong phân tử của glucozơ có nhiều nhóm hiđroxyl, người ta cho dung dịch glucozơ phản ứng với Cu(OH)2 ở nhiệt độ thường.
Chọn đáp án D.
Câu 9:
Khi cho metylamin và anilin lần lượt tác dụng với HBr và dung dịch Br2 sẽ thu được kết quả nào dưới đây?
CH3NH2 + HBr CH3NH3Br;
C6H5NH2 + HBr C6H5NH3Br
C6H5NH2 + 3Br2 C6H2Br3NH2↓ + 3HBr
Chọn đáp án C.
Câu 10:
Nhận định nào sau đây đúng khi xảy ra phản ứng giữa các chất trong mỗi ống nghiệm được mô tả trên hình vẽ bên?
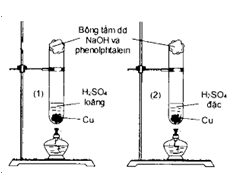
Tại ống nghiệm có phản ứng:
Cu + 2H2SO4(đặc) CuSO4 + SO2 + 2H2O
SO2 + 2NaOH Na2SO3 + H2O
SO2 + Na2SO3 + H2O 2NaHSO3
Miếng bông trên miệng ống nghiệm 2 mất màu hồng.
Chọn đáp án D.
Câu 11:
Các amino axit no có thể phản ứng với tất cả các chất trong nhóm nào sau đây?
Ví dụ:
NH2RCOOH + NaOH NH2RCOONa + H2O
NH2RCOOH + HCl ClNH3RCOOH
NH2RCOOH + C2H5OH NH2RCOOC2H5 + H2O
Chọn đáp án C.
Câu 12:
Cho các sơ đồ phản ứng sau:
(a) X (dư) + Ba(OH)2 → Y + z
(b) X + Ba(OH)2 (dư) → Y + T + H2O.
Biết các phản ứng đều xảy ra trong dung dịch và chất Y tác dụng được với dung dịch H2SO4 loãng. Hai chất nào sau đây đều thỏa mãn tính chất của X?
Dựa vào các phương án lựa chọn đề bài cho, ta dễ thấy X là muối nhôm
Chất Y tác dụng với H2SO4 loãng nên Y không thể là BaSO4 X không thể là Al2(SO4)3.
X không thể là Al(OH)3 vì lúc đó sẽ không có sản phẩm T.
Vậy hai chất thỏa mãn tính chất của X là AlCl3, Al(NO3)3.
Chọn đáp án D.
Câu 13:
Phát biểu nào sau đây không đúng?
Các amino axit có số nhóm –COOH nhiễu hơn số nhóm –NH2 làm quỳ tím chuyển đỏ
Các amino axit có số nhóm –COOH ít hơn số nhóm –NH2 làm quỳ tím chuyển xanh
Các amino axit có số nhóm –COOH bằng số nhóm –NH2 không làm quỳ tím chuyển màu
Chọn đáp án D.
Câu 14:
Cho các phát biểu sau:
Kim loại Cu khử được ion trong dung dịch.
Thạch cao nung được dùng để đúc tượng, bó bột khi gãy xương, làm phấn viết bảng,….
Khi cho CrO3 tác dụng với nước tạo thành dung dịch chứa hai axit.
Al(OH)3 vừa tác dụng được với dung dịch NaOH vừa tác dụng được với dung dịch HCl.
Để dây thép ngoài không khí ẩm, sau một thời gian thấy dây thép bị ăn mòn điện hoá.
Số phát biểu đúng là
Các phát biểu đúng là:
Thạch cao nung được dùng để đúc tượng, bó bột khi gãy xương, làm phấn viết bảng,....
Khi cho CrO3 tác dụng với nước tạo thành dung dịch chứa hai axit.
Al(OH)3 vừa tác dụng được với dung dịch NaOH vừa tác dụng được với dung dịch HCl.
Để dây thép ngoài không khí ẩm, sau một thời gian thấy dây thép bị ăn mòn điện hoá.
Chọn đáp án A.
Câu 15:
Hợp chất X là một -amino axit. Cho 0,01 mol X tác dụng vừa đủ với 80 ml dung dịch HCl 0,125M, sau đó đem cô cạn dung dịch thu được 1,835 gam muối. Phân tử khối của X là.
A có 1 nhóm NH2.
.
Chọn đáp án B.
Câu 16:
Nhận xét không đúng là.
Cr2O3 tác dụng được với dung dịch NaOH đặc khi đun nóng
Cr2O3 + 2NaOH + 3H2O
Chọn đáp án C.
Câu 17:
Hỗn hợp X gồm metylamin, etylamin và trimetylamin có tổng khối lượng 33,76 gam là và tỉ lệ vê' số mol là 2 : 2 : 1. cho hỗn hợp X trên tác dụng hết với dung dịch HCl thu được dung dịch chứa bao nhiêu gam muối?
Đặt 2a, 2a, a (mol) là số mol metylamin, etylamin, trimetylamin
Chọn đáp án B.
Câu 18:
Kết quả thí nghiệm của các dung dịch X, Y, Z với thuốc thử được ghi ở bảng sau.
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Dung dịch Na2SO4 dư |
Kết tủa trắng |
|
Y |
Dung dịch X dư |
Kết tủa trắng tan trong dung dịch HCl dư |
|
Z |
Dung dịch X dư |
Kết tủa trắng không tan trong dung dịch HCl dư |
Dung dịch X, Y, Z lần lượt là
Ba(OH)2 + Na2SO4 BaSO4↓ + 2NaOH
MgCl2 + Ba(OH)2 Mg(OH)2↓ + BaCl2
Al2(SO4)3 + 4Ba(OH)2 + 3BaSO4↓
Chọn đáp án B.
Câu 19:
Cho các loại tơ sợi sau. tơ tằm, tơ capron, tơ visco, tơ nilon-6,6, tơ nitron, tơ xenlulozơ điaxetat. Tơ tổng hợp là.
Tơ tổng hợp bao gồm:
tơ capron
tơ nilon-6,6
tơ nitron
Chọn đáp án B.
Câu 20:
Sục từ từ khí CO2 đến dư vào dung dịch gồm a mol NaOH và b mol Ca(OH)2. Sự phụ thuộc của số mol kết tủa CaCO3 vào số mol CO2 được biểu diễn theo đồ thị sau:
Tỉ số a : b là
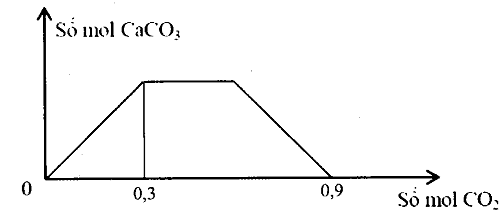
Khi kết tủa bị hòa tan hoàn toàn thì dung dịch chứa NaHCO3 (a mol) và Ca(HCO3)2 (b mol)
Chọn đáp án A.
Câu 21:
Thực hiện các thí nghiệm sau.
Cho NaHCO3 vào dung dịch CH3COOH.
Cho phần đạm amoni vào dung dịch Ba(OH)2 đun nóng.
Cho Fe2O3 vào dung dịch HNO3 đặc, nóng.
Cho P vào dung dịch H2SO4 đặc, nóng.
Cho Al4C3 vào nước.
Cho phèn chua vào nước vôi trong dư.
Cho dung dịch HCl dư vào dung dịch Na2CO3.
Số thí nghiệm chắc chắn có khí thoát ra là
Xét từng thí nghiệm:
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2P + 5H2SO4 đặc → 2H3PO4 + 5SO2 + 2H2O
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Phèn chua có công thức: K2SO4.Al2(SO4)3.24H2O
Nước vôi trong là: Ca(OH)2
4Ca(OH)2 + Al2(SO4)3 → 3CaSO4 +
2H+ + → CO2 + H2O.
Chọn đáp án C.
Câu 22:
Cho sơ đồ chuyển hóa sau:
Tinh bột → X → Y → axit axetic. X và Y lần lượt là.
Câu 23:
Cho các phát biểu sau.
Phân tử chất hữu cơ luôn chứa nguyên tố cacbon và hiđro.
Tơ xenlulozơ axetat thuộc loại tơ tổng hợp.
Nước ép của chuối chín không có khả năng tham gia phản ứng tráng gương.
Trong phân tử tripeptit glu-lys-ala có chứa 4 nguyên tử N.
H2N-CH2-CH2-CO-NH-CH2-COOH là một đipeptit.
Số phát biểu đúng là
Phân tử chất hữu cơ luôn chứa nguyên tố cacbon và hiđro sai vì theo định nghĩa hợp chất hữu cơ luôn chứa nguyên tố cacbon không nhất thiết chứa hidro.
Tơ xenlulozơ axetat thuộc loại tơ tổng hợp sai vì đây là tơ bán tổng hợp hay là tơ nhân tạo.
Nước ép của chuối chín không có khả năng tham gia phản ứng tráng gương sai vì nước ép của chuối chín có chứa glucozơ nên tham gia phản ứng tráng gương.
Trong phân tử tripeptit glu-lys-ala có chứa 4 nguyên tử N đúng vì glu và ala có IN còn lys có 2N.
H2N-CH2-CH2-CO-NH-CH2-COOH là một đipeptit sai vì chất này không được tạo bởi 2 -aminoaxit.
Chọn đáp án D.
Câu 24:
Khi đốt cháy hoàn toàn 8,8 gam chất hữu cơ X đơn chức thu được sản phẩm cháy chỉ gồm 8,96 lít CO2 (ở đktc) và 7,2 gam nước. Nếu cho 8,8 gam hợp chất X tác dụng với dung dịch NaOH vừa đủ đến khi phản ứng hoàn toàn, thu được 9,6 gam muối của axit hữu cơ Y và chất hữu cơ Z. Tên của X là
Bảo toàn khối lượng
Bảo toàn O X là C4H8O2
Y là RCOONa (0,1 mol)
Vậy X là C2H5COOCH3 (metyl propionat).
Chọn đáp án C.
Câu 25:
Cho các tính chất sau:
Chất lỏng ; Chất rắn ; Nhẹ hơn nước ; Không tan trong nước ; Tan trong xăng ; Dễ bị thủy phân ; Tác dụng với kim loại kiềm ; Cộng H2 vào gốc ancol .
Tính chất đặc trưng của lipit là
Tính chất đặc trưng của lipit là:
Nhẹ hơn nước ; Không tan trong nước ; Tan trong xăng ; Dễ bị thủy phân ;
Chọn đáp án C
Câu 26:
Cho hỗn hợp X gồm 0,15 mol H2NC3H5(COOH)2 (axit glutamic) và 0,1 mol H2N(CH2)4CH(NH2)COOH (lysin) vào 250 ml dung dịch NaOH 2M, thu được dung dịch Y. Cho HCl dư vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, số mol HCl đã phản ứng là
Câu 27:
Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit , thu được V lít (ở đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là
Đặt x, y là số mol NO và NO2
Bảo toàn electron:
.
Chọn đáp án C.
.
Câu 28:
Polivinyl clorua (PVC) được điều chế từ khí thiên nhiên theo sơ đồ các quá trình chuyển hóa và hiệu suất như sau:
Metan Axetilen Vinyl clorua PVC.
Tù 4480 m3 khí thiên nhiên (đo ở đktc) điều chế được bao nhiêu kg PVC? Biết metan chiếm 90% thể tích khí thiên nhiên
Bảo toàn nguyên tố cacbon ta có:
2CH4 CH2=CH-Cl
Ta có:
Hiệu suất của cả quá trình: .
khối lượng PVC thực tế thu được là: .
Chọn đáp án D.
Câu 29:
Thủy phân hoàn toàn 30 gam hỗn hợp hai đipetit mạch hở thu được 30,9 gam hỗn hợp X gồm các amino axit (các amino axit chỉ có một nhóm amino và một nhóm cacboxyl trong phân tử). Nếu cho 1/2 hỗn hợp X tác dụng với dung dịch NaOH (vừa đủ), cô cạn dung dịch thì lượng muối khan thu được là.
Đipeptit + H2O → 2 Amino Axit (NH2RCOOH)
1/2 hỗn hợp X có khối lượng 15,45 gam và số mol là 0,05 mol
Chọn đáp án D.
Câu 30:
Đốt cháy hoàn toàn 35,44 gam một chất béo X (triglixerit), sinh ra 51,072 lít (đktc) khí CO2 và 38,16g H2O. Cho 70,88 gam X tác dụng vừa đủ với dung dịch NaOH thì khối lượng muối tạo thành là
Bảo toàn khối lượng:
Bảo toàn nguyên tố O
Số mol X tương ứng với 70,88g là:
Câu 31:
Cho các phát biểu sau
(a) Kim loại Cu oxi hóa được Fe3+ trong dung dịch.
(b) Tơ tằm kém bền trong môi trường axit và môi trường kiềm.
(c) Cao su lưu hóa có tính đàn hồi, lâu mòn và khó tan hơn cao su thiên nhiên.
(d) Gly-Ala-Ala có phản ứng màu biure.
(e) Cho dung dịch NH3 vào dung dịch AlCl3 có xuất hiện kết tủa.
(f) Hỗn hợp Na2O và Al (tỉ lệ mol 1 : 1) tan hết trong nước dư.
(g) Trong công nghiệp dược phẩm, NaHCO3 được dùng đề điều chế thuốc đau dạ dày.
Số phát biểu đúng là
Câu 32:
Cho các phát biểu sau
(a) Thủy phân hoàn toàn xenlulozơ hay tinh bột đều thu được glucozơ.
(b) Thủy phân hoàn toàn các triglixerit luôn thu được glixerol.
(c) Anilin là chất khí tan nhiều trong nước.
(d) Metylamin là chất khí tan nhiều trong nước.
(e) Protein đơn giản chứa các gốc α-amino axit.
(f) Trong công nghiệp được phẩm, NaHCO3 được dùng để điều chế thuốc dạ dày.
(g) Hỗn hợp Na và Al2O3 (tỉ lệ mol 2:3 tương ứng) tan hết trong nước dư.
Số phát biểu đúng là
Có 5 phát biểu đúng: (a), (b), (d), (e), (f)
Chọn đáp án C.
Câu 33:
Cho các phát biểu sau
(a) Dầu dừa được dùng làm nguyên liệu để điều chế xà phòng.
(b) Nước ép quả nho chín có phản ứng tráng bạc.
(c) Saccarozo có phản ứng tráng bạc.
(d) Phân tử Gly-Ala-Val có 3 nguyên tử nitơ.
(e) Cho viên Zn vào dung dịch HCl thì viên Zn bị ăn mòn hóa học.
(f) Tơ poliamit kém bền trong dịch dịch axit và dung dịch bazơ.
(g) Phân tử Gly-Ala có bốn nguyên tử oxi.
Số phát biểu đúng là
Có 5 phát biểu đúng: (a), (b), (d), (e), (f).
Chọn đáp án B.
Câu 34:
Cho các phát biểu sau
(a) Dung dịch lysin không làm đổi màu quỳ tím.
(b) Dung dịch glyxin làm quỳ tím chuyển màu đỏ
(c) Quặng boxit là nguyên liệu dùng để sản xuất nhôm.
(d) Đốt Fe trong khí clo dư thu được FeCl3.
(e) Phèn chua được sử dụng để làm trong nước đục.
(f) Miếng gang để trong không khí ẩm có xảy ra ăn mòn điện hóa
(g) Đun nóng dung dịch Ca(HCO3)2 có xuất hiện kết tủa.
Số phát biểu đúng là
Có 5 phát biểu đúng: (c), (d), (e), (f), (g)
Chọn đáp án D.
Câu 35:
Cho 19,5 gam hỗn hợp gồm 3 amino axit, công thức phân tử đều có dạng NH2R(COOH)2 vào dung dịch chứa 0,05 mol axit axetic, thu được dung dịch X. Thêm tiếp 300 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được 30 gam chất rắn khan Y. Hòa tan Y trong dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là
Bảo toàn khối lượng:
Số mol HCl phản ứng tối đa với Y là .
Bảo toàn khối lượng:
Chọn đáp án B.
Câu 36:
Cho gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,15M và Fe(NO3)3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn thì thu được gam chất rắn X và dung dịch Y. Cho NaOH dư vào dung dịch Y, kết thúc phản ứng không thu được kết tủa. Lấy gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (ở đktc). Giá trị của và lần lượt là
và
Cho NaOH dư vào dung dịch Y, kết thúc phản ứng không thu được kết tủa dung dịch Y chỉ chứa Al(NO3)3 chất rắn X gồm Cu (0,015), Fe (0,02 mol), Al dư
Câu 37:
Hỗn hợp X gồm FeO, Al2O3 Mg, Zn. Hòa tan m gam hỗn hợp X bằng dung dịch HCl vừa đủ thì thu được dung dịch chứa gam muối. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư thu được 13,44 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 1,792 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hidro là 18,5, dung dịch Y. Số mol HNO3 đã tham gia phản ứng gần giá trị nào nhất sau đây?
Bảo toàn electron
Đặt
Bảo toàn H
Mặt khác:
Với HNO3:
và
Bảo toàn electron
Chọn đáp án A.
Câu 38:
Hỗn hợp X gồm FeO, Al2O3 Mg, Zn. Hòa tan m gam hỗn hợp X bằng dung dịch HCl vừa đủ thì thu được dung dịch chứa gam muối. Cho m gam hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư thu được 13,44 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 1,792 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với hidro là 18,5, dung dịch Y. Số mol HNO3 đã tham gia phản ứng gần giá trị nào nhất sau đây?
Bảo toàn electron
Đặt
Bảo toàn H
Mặt khác:
Với HNO3:
và
Bảo toàn electron
Chọn đáp án A.
Câu 39:
Tiến hành thí nghiệm phản ứng màu biure
Bước 1: Cho vào ống nghiệm 1 ml dung dịch protein 10%, 1ml dung dịch NaOH 30% và 1 giọt dung dịch CuSO4 2%.
Bước 2: Lắc nhẹ ống nghiệm
Phát biểu nào sau đây đúng?
CuSO4 phản ứng với NaOH tạo kết tủa màu xanh lam Cu(OH)2
Phản ứng giữa Cu(OH)2 với các nhóm peptit -CO-NH tạo ra sản phẩm màu tím đặc trưng.
=> Phát biểu đúng: Sau bước 2, dung dịch xuất hiện màu tím đặc trưng.
Chọn đáp án A.
Câu 40:
Khí gồm NO và H2
Do có H2 nên hết, bảo toàn N được:
Y tác dụng với dung dịch gồm NaNO3 và H2SO4 (loãng) sinh khí T (NO và H2) Y có Fe dư
Z gồm chỉ gồm NO2 và CO2 không có O2: và
và
Quy đổi X thành: Fe (x mol), (a mol: bảo toàn N) và (b mol: bảo toàn C)
Bảo toàn khối lượng:
Quy đổi Y thành: Fe (0,25 mol) và O (y mol)
Trong m gam muối, đặt u và v là số mol Fe2+ và Fe3+
Bảo toàn Fe:
Bảo toàn điện tích:
Bảo toàn electron:
Giải hệ :
; ;
Khối lượng muối:
Chọn đáp án D.
Câu 41:
X là este mạch hở có công thức phân tử C5H8O2; Y và Z là hai este (đều no, mạch hở, tối đa hai nhóm este, ). Đốt cháy hoàn toàn 0,3 mol hỗn hợp E gồm X, Y và Z, thu được 23,52 lít CO2 (đktc). Mặt khác, cho 51,4 gam E tác dụng với dung dịch NaOH vừa đủ, thu được hỗn hợp hai muối và hỗn hợp hai ancol có cùng số cacbon. Đem toàn bộ lượng ancol này cho tác dụng với Na dư thu được 7,84 lít H2 (đktc). Phần trăm khối lượng của ancol có phân tử khối nhỏ hơn là
Giải đốt 0,3 mol E + O2 1,05 mol CO2 + ? mol H2O.
có các khả năng cho Y là HCOOCH3; HCOOC2H5 và CH3COOCH3.
Tuy nhiên chú ý rằng thủy phân E thu được 2 ancol có cùng số C Y phải là HCOOC2H5 để suy ra được rằng ancol cùng số C còn lại là C2H4(OH)2.
cấu tạo của X là CH2=CH-COOC2H5 và este Z no là (HCOO)2C2H4.
Trong 0,3 mol hỗn hợp E: đặt số mol của X, Y, Z lần lượt là x, y, z.
Ta có:
Bảo toàn C: Trong 51,4 gam hỗn hợp E: đặt số mol của X, Y, Z lần lượt là kx, yk, kz. Ta có:
Giải hệ , ta được
số mol ; số mol
Chọn đáp án C.
