20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án ( Đề 7)
-
1998 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Công thức cấu tạo của metyl acrylat là?
Este metyl acrylat có công thức cấu tạo là: CH2=CHCOOCH3.
Chọn đáp án C.
Câu 2:
Sắt tây là sắt được tráng một lớp mỏng kim loại T để bảo vệ sắt không bị ăn mòn theo phương pháp bảo vệ bề mặt. Kim loại T là
Sắt tây là sắt được tráng thiếc (Sn), được sử dụng làm vỏ bao bì thực phẩm do có độ bền cơ học cao, không thấm nước, không độc, chống ánh sáng và bảo quản hương vị thực phẩm.
Chọn đáp án C.
Câu 3:
Trong các hợp chất sau, hợp chất nào là chất béo?
Chất béo là trieste của glixerol và axit béo đơn chức có số chẵn nguyên tử C (từ 12C – 24C) không phân nhánh, gọi chung là triglixerit hay triaxylglixerol.
(C17H35COO)3C3H5: tristearin là trieste của glixerol (C3H5(OH)3) và axit strearic (C17H35COOH).
Chọn đáp án A.
Câu 4:
Khí CO (cacbon monoxit) là chất khí cực kỳ nguy hiểm, hít thở một lượng quá lớn CO sẽ dẫn tới thương tổn do giảm lượng oxi trong máu, tổn thương hệ thần kinh cũng như có thể gây tử vong. Nồng độ khoảng 0,1% cacbon monoxit trong không khí cũng có thể nguy hiểm đến tính mạng.
CO là chất khí không màu, không mùi và không gây kích ứng nên rất nguy hiểm vì người ta không cảm nhận được sự hiện diện của CO trong không khí. CO có khả năng liên kết với hemoglobin (Hb) trong hồng cầu mạnh hơn oxi nên khi được hít vào phổi CO sẽ gắn chặt với Hb thành HbCO do đó máu không hề chuyên chở oxi đến tế bào.
Triệu chứng ngộ độc CO thường bắt đầu bằng cảm giác bần thần, nhức đầu, buồn nôn, khó thở rồi từ từ đi vào hôn mê. Nếu ngộ độc CO xảy ra khi đang ngủ say hoặc uống rượu say thì người bị ngộ độc sẽ hôn mê từ từ, ngưng thở và tử vong.
Ngộ độc CO có thể xảy ra ở những trường hợp chạy máy nổ phát điện trong nhà kín, người ngủ trong xe hơi đang nổ máy trong nhà hoặc gara.
Chọn đáp án C.
Câu 5:
Phần đầu mỗi que diêm được nhúng, tẩm hỗn hợp của KClO3, Sb2S3 và chất kết dính. Phần quẹt trên vỏ bao diêm chứa hỗn hợp bột ma sát, chất kết dính và chất X (dạng bột, không phát quang trong bóng tối). Chất X là?
Chất X là photpho đỏ (dạng bột màu đỏ, không có khả năng phát quang trong bóng tối).
Chọn đáp án D.
Câu 6:
Tìm từ thích hợp để điền vào chỗ trống trong đoạn văn sau:
“Ở dạng mạch hở glucozo và fructozo đều có nhóm cacbonyl, nhưng trong phân tử fructozo nhóm cacbonyl ở nguyên tử C số …., còn trong phân tử glucozo nhóm cacbonyl ở nguyên tử C số…. Trong môi trường bazo, fructozo có thể chuyển hóa thành … và …”
“Ở dạng mạch hở glucozo và fructozo đều có nhóm cacbonyl, nhưng trong phân tử fructozo nhóm cacbonyl ở nguyên tử C số 2, còn trong phân tử glucozo nhóm cacbonyl ở nguyên tử C số 1. Trong môi trường bazo, fructozo có thể chuyển hóa thành glucozo và ngược lại”.
Chọn đáp án A.
Câu 7:
Số đồng phân akin C5H8 tác dụng được với dung dịch AgNO3/NH3 tạo kết tủa vàng là?
Điều kiện để một ankin có thể tác dụng với dung dịch AgNO3/NH3 tạo kết tủa vàng là ankin đó phải có nối ba đầu mạch.
Các đồng phân của ankin C5H8 có cấu tạo thỏa mãn điều kiện trên là:
và
Chọn đáp án C
Câu 8:
Cho các chất sau: CH3NH2; NH3; C6H5NH2 và CH3NHCH3. Chất có lực bazo mạnh nhất là?
Nếu gốc R là đẩy e thì nó sẽ đẩy e vào nguyên tử N, làm tăng mật độ điện tích âm trên N. Do đó, N dễ nhận proton hơn, tính bazo sẽ tăng. Nếu càng nhiều gốc R đẩy e thì mật độ e trên N lại càng tăng, tính bazo càng mạnh nữa.
Ngược lại, nếu gốc R hút e, thì nó sẽ làm giảm mật độ e trên nguyên tử N. Mật độ điện tích âm giảm, N sẽ khó nhận proton hơn, tính bazo sẽ giảm. Và cũng tương tự như trên, nếu càng nhiều gốc hút e thì tính bazo lại càng giảm nữa.
Theo đầu bài, các gốc đẩy e như ankyl −CH3) làm tăng tinh sbazo của amin. Các gốc hút e như phenyl
−C6H5) làm giảm tính bazo của amin.
Sắp xếp lực bazo tăng dần như sau: C6H5NH2 < NH3 < CH3NH2 < CH3NHCH3.
Vậy chất có lực bazo mạnh nhất là: CH3NHCH3.
Chọn đáp án A.
Câu 9:
Dãy sắp xếp theo chiều tăng dần nhiệt độ sôi của các chất là:
C2H5Cl < C2H5OH < CH3COOH
Chọn đáp ánC.
Câu 10:
Thủy phân este E có công thức phân tử C4H8O2 với xúc tác axit vô cơ loãng, thu được hai sản phẩm hữu cơ X, Y (chỉ chứa các nguyên tử C, H, O). Từ X có thể điều chế trực tiếp ra Y. Este E là?
Este có công thức tổng quát là: RCOOR’. Để từ X có thể điều chế trực tiếp ra Y thì E phải có công thức cấu tạo là: CH3COOC2H5. Các phương trình phản ứng là:
Chọn đáp án B.
Câu 11:
Cho 13,2 gam CH3COOC2H5 phản ứng hết với dung dịch NaOH (dư), đun nóng. Khối lượng muối CH3COONa thu được là?
Phương trình phản ứng xà phòng hóa:
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
0,15 0,15
Ta có:
Chọn đáp án D.
Câu 12:
Cho vào ống nghiệm một vài tinh thể K2CrO4, sau đó thêm tiếp khoảng 1 ml nước cất và lắc đều thu được dung dịch X. Thêm vài giọt dung dịch HCl vào X thu được dung dịch Y. Hai dung dịch X và Y lần lượt có màu.
Dung dịch K2CrO4 có màu vàng (X)
Khi cho H+ vào thì sẽ chuyển sang da cam (Y) theo cân bằng sau:
(màu vàng) (màu da cam)
Chọn đáp án B.
Câu 13:
Đốt cháy hoàn toàn m gam ankađien X, thu được 8,96 lít CO2 (đktc) và 5,4 gam H2O. Cho m gam X tác dụng với dung dịch nước brom. Số mol brom tối đa tham gia phản ứng là bao nhiêu?
Từ phương trình phản ứng (2) ta có: Số mol brom tối đa tham gia phản ứng là 0,2 (mol)
Chọn đáp án B.
Câu 14:
Hai hợp chất hữu cơ X và Y có cùng công thức phân tử là C3H7NO2, đều là chất rắn ở điều kiện thường. Chất Y có phản ứng trùng ngưng tạo peptit. Chất X phản ứng với dung dịch kiềm có khí thoát ra.
Các chất X và Y lần lượt là?
Theo đề X và Y đều là chất rắn X, Y là amino axit hoặc muối amoni.
+ X tác dụng với NaOH tạo khí X là muối amoni: CH2= CH – COONH4
+ Y có phản ứng trùng ngưng tạo peptit Y là amino axit: CH3 – CH(NH2) – COOH
Vậy tên gọi của X, Y lần lượt là amoni acrylat và axit 2-aminopropanoic.
Chọn đáp án B.
Câu 15:
Sục V lít CO2 (đktc) vào bình đựng 1 lít dung dịch Ba(OH)2 0,2M. Sau phản ứng thu được 19,7 gam kết tủa. Giá trị của V là?
Theo đầu bài ta có:
TH1: CO2 + Ba(OH)2 BaCO3 + H2O (1)
0,1 0,1
Từ (1)
TH2: CO2 + Ba(OH)2 BaCO3 + H2O (2)
0,1 0,1 0,1
2CO2 + Ba(OH)2 Ba(HCO3)2 (3)
0,2 0,1 0,1
Từ (2), (3)
Vậy, từ (1), (2), (3)
Chọn đáp án D.
Câu 16:
Cho 3,245 gam hỗn hợp A gồm Fe3O4, Cr2O3 và CuO tác dụng vừa đủ với 80ml dung dịch HCl 2M. Cô cạn dung dịch thu được khối lượng muối khan là?
Ta có phương trình phản ứng dạng tổng quát như sau:
Oxit kim loại + HCl muối clorua + H2O (1)
Ta luôn có:
Áp dụng định luật bảo toàn khối lượng cho phản ứng (1):
Khối lượng muối clorua + khối lượng H2O = khối lượng oxit + khối lượng HCl
Khối lượng muối clorua = 3,245 + 0,16.36,5 – 0,08.18 = 7,645 (gam)
Chọn đáp án C.
Câu 17:
Tiến hành trộn 300ml dung dịch HCl 0,3M với 200ml dung dịch NaOH 1,5M. Giá trị pH của dung dịch thu được sau phản ứng là?
Tính số mol H+ và OH- trong mỗi dung dịch đem trộn:
Từ phương trình ion rút gọn của phản ứng trung hòa số mol H+ sau phản ứng:
Ban đầu: 0,09 0,3
Phản ứng: 0,09 0,09
Sau phản ứng: 0 0,21
Sau phản ứng: nOH- dư = 0,21 (mol)
Chọn đáp án B.
Câu 18:
Cho 32,5 gam hỗn hợp X gồm: Al2O3, ZnO, FeO, MgO tác dụng hết với CO dư, nung nóng, thu được 24,5 gam hỗn hợp Y. Cho Y tác dụng hết với HCl dư thu được V lít khí H2 (đktc). Giá trị của V là?
Chỉ có ZnO, FeO bị khử bởi CO Y gồm: Al2O3, Zn, Fe, MgO.
Khối lượng rắn giảm:
Trong quá trình phản ứng trên chỉ có nguyên tố C và nguyên tố H thay đổi số oxi hóa (vì kim loại trong oxit sau đó lại đi vào muối nên số oxi hóa không thay đổi)
Bản chất của quá trình phản ứng trên là:
Bảo toàn e: (lít)
Chọn đáp án A.
Câu 19:
Cho các chất sau: Cao su Buna (1), metan (2), etilen (3), axetilen (4), divinyl (5), ancol etylic (6). Dãy nào sau đây được sắp xếp theo đúng thứ tự xảy ra trong quá trình điều chế cao su Buna là?
Các phương trình phản ứng xảy ra như sau:
Chọn đáp án B.
Câu 20:
Theo đề bài ta có:
Câu 21:
Tiến hành các thí nghiệm sau:
(a) Cho lá Fe nguyên chất vào dung dịch CuCl2.
(b) Cho lá Al nguyên chất vào dung dịch HCl.
(c) Cho lá Zn dư, nguyên chất vào dung dịch FeCl3.
(d) Cho lá Ni nguyên chất vào dung dịch FeCl2.
Số thí nghiệm có thể xảy ra ăn mòn điện hóa là?
(a) Đúng, Fe bị ăn mòn điện hóa theo phản ứng: Fe + CuCl2 FeCl2 + Cu.
Tại catot (Cu):
Tại anot (Fe):
(b) Sai, Al bị ăn mòn hóa học theo phản rứng: 2Al + 6HCl 2AlCl3 + 3H2.
(c) Đúng, Zn bị ăn mòn điện hóa theo phản ứng:
Zn + 2FeCl3 ZnCl2 + 2FeCl2
Zndư + FeCl2 ZnCl2 + Fe
Tại catot (Fe):
Tại anot (Zn):
(d) Sai, không xảy ra phản ứng.
Chọn đáp án D.
Câu 22:
Thủy phân hết m gam tetrapeptit Ala – Ala – Ala (mạch hở) thu được hỗn hợp gồm 28,48 gam Ala, 32 gam Ala – Ala và 27,72 gam Ala-Ala-Ala. Giá trị của m là?
Công thức tổng quát của peptit là:
Với
Với Với
Bảo toàn số mol Ala ta có:
Mặt khác:
Chọn đáp án C.
Câu 23:
Cho 6,2 gam hỗn hợp hai ancol no, đơn chức, kế tiếp trong cùng dãy đồng đẳng, tác dụng hoàn toàn với 4,6 gam natri, thu được 10,65 gam chất rắn. Số nguyên tử cacbon trung bình của hai ancol trên là?
Bảo toàn khối lượng ta có:
Đặt công thức phân tử chung của 2 ancol là:
Chọn đáp án D.
Câu 24:
Kết luận nào sau đây là đúng?
A.Sai, nước cứng là nước có nhiều ion và
B. Sai, hỗn hợp tecmit dùng hàn đường ray xe lửa là hỗn hợp gồm Al và Fe2O3
C. Sai, nguyên tắc để điều chế kim loại là khử ion kim loại thành kim loại.
D. Đúng, kim loại phản ứng mãnh liệt với nước nhất là K.
Chọn đáp án D.
Câu 25:
Khối lượng muối thu được sau cô cạn là:
mmuối = mrắn – mNa(OH) (dư) = 11,7 – 0,05.40 = 9,7(gam)
Mmuối Công thức của muối là: H2NCH2COONa X là: H2NCH2COOCH3.
Chọn đáp án D.
Câu 26:
Cho các dãy chuyển hóa. Vậy X2 là
Phương trình phản ứng:
H2NCH2COOH + NaOH H2NCH2COONa (X1) + H2O
H2NCH2COONa + 2HCldư ClH3NCH2COOH (X2) + NaCl
Chọn đáp án A.
Câu 27:
Thủy phân hoàn toàn 3,4,2 gam hỗn hợp X gồm saccarozo và mantozo thu được hỗn hợp Y. Biết rằng hỗn hợp Y phản ứng vừa đủ 0,015 mol Br2. Nếu đem dung dịch chứa 3,42 gam hỗn hợp X cho phản ứng lượng dư AgNO3/NH3 thì khối lượng Ag tạo thành là? Biết mantozo gồm 2 gốc glucozo liên kết với nhau và mantozo phản ứng với AgNO3/NH3 tạo Ag theo tỉ lệ nmantozo : nAg = 1: 2
Đặt số mol của saccarozo và mantozo trong hỗn hợp X tương ứng là x và y, ta có các phương trình phản ứng:
C12H22O11 + H2O C6H12O6 + C6H12O6 (1)
(saccarozo) (glucozo) (glucozo)
x x x(mol)
C12H22O11 + H2O 2C6H12O6 (2)
(mantozo) (glucozo)
y 2y (mol)
CH2OH[CHOH]4CHO + Br2 + H2O CH2OH[CHOH]4COOH + 2HBr (3)
x + 2y x + 2y
C12H22O11 2Ag (4)
(mantozo)
y 2y
Theo (1), (2), (3) và giả thiết ta có:
Khi cho hỗn hợp X tham gia phản ứng tráng gương thì chỉ có mantozo phản ứng
(4) mAg = 0,005.2.108 = 1,08 (gam)
Chọn đáp án C.
Câu 28:
Điện phân nóng chảy Al2O3 với anot than chì (hiệu suất điện phân 100%) thu được m gam Al ở catot và 6,72 lít (ở đktc) hỗn hợp khí X có tỉ khối so với hidro bằng 16. Lấy 3,36 lít (ở đktc) hỗn hợp khí X sục vào dung dịch nước vôi trong (dư) thu được 3 gam kết tủa. Giá trị của m là?
Lấy 0,15(mol)X
Các phản ứng xảy ra:
2Al2O3 4Al + 3O2; C + O2 CO2; 2C + O2 2CO
0,15mol X + Ca(OH)2 (dư) thu được 0,03 mol CaCO3
Chọn đáp án C.
Câu 29:
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy.
(b) Điện phân dung dịch CuSO4 (điện cực trơ).
(c) Cho mẩu K vào dung dịch AlCl3.
(d) Cho Fe vào dung dịch CuSO4.
(e) Cho Ag vào dung dịch HCl.
(f) Cho Cu vào dung dịch hỗn hợp Cu(NO3)2 và NaHSO4.
Số thí nghiệm thu được chất khí là?
a) 2NaCl 2Na + Cl2
b) CuSO4 + H2O Cu + H2SO4
c) K + H2O KOH
3KOH + AlCl3 Al(OH)3 + 3KCl
d) Fe + CuSO4 FeSO4 + Cu
e) Không xảy ra phản ứng
f)
Có 4 thí nghiệm (a, b, c, f) sinh ra chất khí.
Chọn đáp án A.
Câu 30:
Cho 4 thí nghiệm như hình vẽ
Có bao nhiêu thí nghiệm đinh (làm bằng thép) không bị ăn mòn điện hóa?
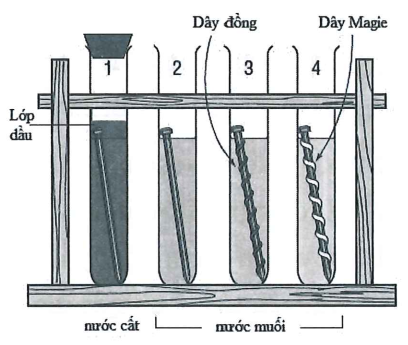
Ăn mòn điện hóa là quá trình oxi hóa khử, trong đó kim loại bị ăn mòn do tác dụng của dung dịch chất điện li và tạo nên dòng electron chuyển dời từ cực âm đến cực dương.
- Điều kiện để xảy ra ăn mòn điện hóa là phải thỏa mãn đồng thời 3 điều kiện sau:
+ Các điện cực phải khác nhau về bản chất.
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
+ Các điện cực cùng tiếp xúc với dung dịch chất điện li.
- Ăn mòn điện hóa thường xảy ra khi cặp kim loại (hoặc hợp kim) để ngoài không khí ẩm, hoặc nhúng trong dung dịch axit, dung dịch muối, trong nước không nguyên chất…
Nhìn vào 4 thí nghiệm trên ta thấy: Có 2 thí nghiệm, trong đó sắt bị ăn mòn điện hóa là: Thí nghiệm số 2 (thép là hợp kim Fe – Cu) và thí nghiệm 3 (Fe bị tan). Còn thí nghiệm 4 thì Mg bị tan, thí nghiệm 1 thì không có dung dịch điện li.
Chọn đáp án B.
Câu 31:
Cho các phát biểu sau:
(1) Công thức của alanin là H2N-CH(CH3)COOH.
(2) Glucozo còn có tên gọi khác là đường nho.
(3) Tơ tằm thuộc loại tơ thiên nhiên.
(4) Các chất CH3NH2, C2H5OH, NaHCO3 đều có khả năng phản ứng với HCOOH.
(5) Trong phân tử vinyl axetat có một liên kết .
Số phát biểu sai là?
Chỉ có phát biểu (5) là sai.
Trong công thức cấu tạo của vinyl axetat (CH3COOCH=CH2) có 2 liên kết
Chọn đáp án A.
Câu 32:
0,05 0,1 0,05 0,05 0,1
Sau khi KCl điện phân hết thì khối lượng dung dịch giảm
M = 0,05.64 + 0,05.71 = 6,75 < 10,75 (gam)
Vậy Cu(NO3)2 tiếp tục bị điện phân. Gọi x là số mol Cu(NO3)2 điện phân ta có:
Vậy dung dịch sau điện phân có KNO3, HNO3 và Cu(NO3)2 dư
Câu 33:
Cho vào 3 ống nghiệm, mỗi xống nghiệm 1 ml CH3COOC2H5. Thêm vào ống nghiệm thứ nhất 2 ml H2O, ống nghiệm thứ hai 2 ml dung dịch H2SO4 20% và ống nghiệm thứ ba 2 ml dung dịch NaOH đặc (dư). Lắc đều 3 ống nghiệm, đun nóng 70 – 80oC rồi để yên từ 5 – 10 phút. Phát biểu nào sau đây không đúng?
Hiện tượng quan sát được tại mỗi ống nghiệm:
(1) Tách lớp do este ít tan trong nước.
(2) Tách lớp do phản ứng este hóa là một phản ứng thuận nghịch nên chỉ có một phần este bị thủy phân trong môi trường axit.
(3) Đồng nhất do phản ứng xà phòng hóa là phản ứng hoàn toàn.
Vậy hiệu suất phản ứng tăng dần từ ống (1) đến ống (3).
Chọn đáp B.
Câu 34:
Nhỏ từ từ dung dịch H2SO4 vào 200ml dung dịch hỗn hợp Ba(OH)2 aM và Ba(AlO2)2 bM, kết quả thí nghiệm thu được như hình vẽ dưới đây:
Giá trị của m + m1 là
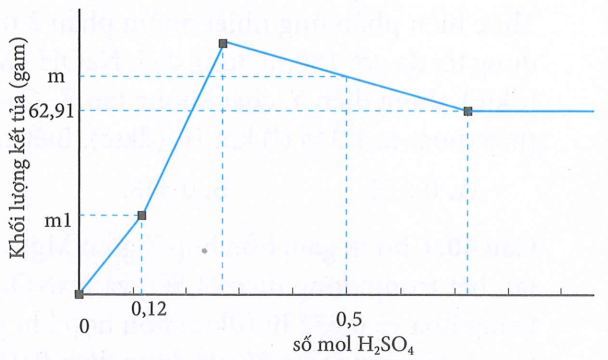
Ta có:
Tại trung hòa hết OH- đồng thời tạo kết tủa của BaSO4
Khi đó:
+) Tại tan hết kết tủa chỉ còn BaSO4
+) Tại
Ta có:
Câu 35:
Hỗn hợp X gồm Ba, BaO, Na, Na2O và K. Cho m gam hỗn hợp X vào nước dư thu được 3,136 lít H2 (đktc), dung dịch Y chứa 7,2 gam NaOH, 0,93 gam Ba(OH)2 và 0,044m gam KOH. Hấp thụ hoàn toàn 7,7952 lít CO2 (đktc) vào dung dịch Y thu được a gam kết tủa. Giá trị của a gần nhất với
Quy đổi X thành Ba, Na, K, O.
tạo 2 muối
Ta có công thức:
Chọn đáp án C.
Câu 36:
Đốt cháy hoàn toàn 11,43 gam este E thuần chức, mạch hở, thu được 12,096 lít khí CO2 (đktc) và 5,67 gam nước. Với 0,1 mol E tác dụng hết với 200ml NaOH 2,5M thu được dung dịch X. Từ dung dịch X, khi cho bay hơi người ta thu được ancol Y còn cô cạn thì thu được 36,2 gam chất rắn khan. Đốt cháy toàn bộ lượng ancol Y thu được 6,72 lít CO2 (đktc). Công thức cấu tạo thu gọn nào sau đây phù hợp với E?
Đặt CTTQ E: nguyên dương).
Ta có tỉ lệ: x:y:z = 6:7:3 CTPT của E : (C3H7O3)n
Ta cos: mà phản ứng hết. Vậy E có ít hơn 5 chức este E có 6 nguyên tử oxi (n=2). Vậy CTTP E : C12H14O6 (M=254 g/mol) E: (RCOO)3R’
(RCOO)3R’ + 3NaOH 3RCOONa + R’(OH)3 (1)
Do có 3 nguyên tử C.
CTCT ancol: CH2OH-CHOH-CH2OH (Glixerol)
Ta có:
Từ (1):Câu 37:
Cho 30 gam hỗn hợp (H) gồm Mg, FeCO3, Fe và Fe(NO3)2 tác dụng vừa đủ với dung dịch HCl, kết thúc phản ứng thu được dung dịch X chứa 54,33 gam muối và 6,78 gam hỗn hợp khí Y gồm NO; H2 và 0,08 mol CO2. Cho dung dịch X tác dụng tối đa với 510 ml dung dịch NaOH 2M, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 26,4 gam rắn. Phần trăm khối lượng của kim loại Fe trong (H) có giá trị gần nhất với
Quy đổi hỗn hợp (H) thành Mg, Fe, CO3 và NO3 ta có sơ đồ:
+ Natri cuối cùng đi về NaCl nHCl pứ = nNaOH = 1,02 (mol)
mHCl pứ = 37,23gam BTKL ta có
+ PT theo mX – mH là: 44a + 62b = 7,08 (1)
+ PT bảo toàn hidro: 4a + 2c = 0,34 (2)
+ PT theo khối lượng khí thoát ra: 30b + 2c = 3,26 (3)
· Giải hệ (1) (2) và (3) ra có a = 0,02, b = 0,1 và c = 0,13
+ Đặt và ta có:
+ PT theo
+ PT theo tổng khối lượng oxit thu được: 40x + 80y = 26,4(4)
· Giải hệ (3) và (4)
nFe kim loại/H
Câu 38:
Thủy phân 21,9 gam este A, hai chức, mạch hở không phân nhánh, tác dụng với tối đa 12 gam NaOH thu được dung dịch chứa 1 muối và hỗn hợp 2 ancol đồng đẳng kế tiếp. Thủy phân 21,9 gam este B, đơn chức, mạch hở, không tráng bạc cần vừa đủ dung dịch chứa 12 gam NaOH. Cho 29,2 gam hỗn hợp chứa cả A và B tác dụng hoàn toàn với 200 ml dung dịch D gồm NaOH 2M và KOH 1M sau phản ứng hoàn toàn. Cô cạn dung dịch thu được m gam chất rắn khan và 7,28 lít hơi hỗn hợp 2 ancol ở (81,9oC, 1atm). Giá trị của m là?
Este A: Vì nNaOH = 0,3 mol; Do Este A hai chức + NaOH thu được dung dịch chứa 1 muối và hỗn hợp 2 ancol đồng đẳng kế tiếp tỉ lệ phản ứng là 1: 2 Este A là 2 chức dạng: R(COO)2 tỉ lệ
Vì tạo 2 ancol nên phải có tối thiểu 1 gốc CH3, 1 gốc C2H5
A là: C2H5OOC-CH2-COOCH3: a (mol)
Este B: Vì nNaOH = 0,3 mol; Este đơn chức, nên tỷ lệ phản ứng hoặc 1 : 1 hoặc 1 : 2
TH1: este dạng RCOOR’ tỷ lệ
TH2: Este dạng RCOOC6H4R’ tỷ lệ 2 gốc: và H; vì este không tráng bạc nên B là:
Khi tác dụng với dung dịch D:
Tổng số mol:
Bảo toàn khối lượng: mrắn =
Chọn đáp án D.
Câu 39:
Chia 43,15 (g) hỗn hợp gồm Al, Fe2O3, Cr2O3 thành 2 phần.
Cho 1,344 (l) khí CO (đktc) đi qua phần 1 nung nóng, sau một thời gian thu được 25,41 (g) rắn và hỗn hợp khí A có tỉ khối so với H2 bằng 18.
Thực hiện phản ứng nhiệt nhôm phần 2 trong khí trơ, thu được hỗn hợp rắn X. Biết X tác dụng tối đa với 180 ml dung dịch NaOH 1M và kết thúc quá trình này thu được V(l) khí H2 (đktc), dung dịch Y, chất không tan Z. Cho Z tác dụng với dung dịch HCl loãng nguội thì thấy thoát ra 1,344 (l) khí H2 (đktc). Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là?
Phần (1): BT C
Phản ứng với HCl loãng nguội
Chọn đáp án A.
Câu 40:
