Đề thi thử THPT môn Hóa năm 2022 có đáp án (Mới nhất) - Đề 6
-
3785 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
X là stiren, công thức: C6H5-CH=CH2.
nC6H5CHCH2 (-CH(C6H5)-CH2-)n (polistiren)
Câu 2:
Glyxin không tác dụng với NaCl. Với các chất còn lại:
H2N-CH2-COOH + H2SO4 → (HSO4)H3N-CH2-COOH
H2N-CH2-COOH + KOH → H2N-CH2-COOK + H2O
H2N-CH2-COOH + NaOH → H2N-CH2-COONa + H2O
Câu 3:
Saccarozơ thuộc loại đisaccarit.
Tinh bột, xenlulozơ thuộc loại polisaccarit.
Glucozơ, frutozơ thuộc loại monosaccarit.
Câu 4:
Etilen: CH2=CH2
Câu 5:
CO không khử được các oxit trong nhóm MgO, Al2O3 vì CO chỉ khử được oxit của các kim loại đứng sau nhôm trong dãy hoạt động hóa học.
Câu 6:
Ion kim loại có tính oxi hóa mạnh dần theo chiều trái sang phải trong dãy điện hóa
K+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Fe3+ Ag+ Hg2+ Pt2+ Au3+
Câu 7:
Natri hiđrocacbonat: NaHCO3
Natri cacbonat: Na2CO3
Natri hiđrosunfit: NaHSO3
Amoni bicacbonat: NH4HCO3
Câu 8:
Khí khi đốt cháy rơm rạ trên đồng ruộng, sinh ra khí X gây hiệu ứng nhà kính là khí CO2.
Câu 9:
Có 4 chất tác dụng (trừ Cu):
CO32- + Fe2+ → FeCO3
Cl2 + Fe2+ → Fe3+ + 2Cl-
4H+ + NO3- + 3Fe2+ → 3Fe3+ + NO + 2H2O
Ag+ + Fe2+ → Fe3+ + Ag
Câu 10:
A. Sai, Na khử H2O trước:
Na + H2O → Na+ + OH- + H2
OH- + Cu2+ → Cu(OH)2
B. Đúng:
Ca + H2O → Ca(OH)2 + H2
Ca(OH)2 + NaHCO3 → CaCO3 + Na2CO3 + H2O
C. Đúng
D. Đúng:
Ca(OH)2 + CO2 → CaCO3 + H2O
Câu 12:
Anilin C6H5NH2 có tính bazơ rất yếu, không làm đổi màu quỳ tím.
Glyxin H2N-CH2-COOH có số nhóm NH2 bằng số nhóm COOH ⇒ Không làm đổi màu quỳ tím.
C2H5NH2 là amin có tính bazo yếu làm quỳ tím chuyển sang màu xanh
Câu 13:
Cacnalit: KCl.MgCl2.6H2O
Dolomit: CaMg(CO3)2.
Hematit là một dạng khoáng vật của oxide sắt (III) (Fe2O3).
Xinvinit là một loại đá trầm tích gồm các hỗn hợp cơ học của khoáng chất Sylvit (KCl) và halit (NaCl).
Câu 14:
Tính dẻo: Au > Ag > Cu > Al > Fe
Tính dẫn điện/nhiệt: Ag > Cu > Au > Al > Fe.
Câu 15:
Vì ăn mòn điện hóa phát sinh dòng điện còn ăn mòn hóa học không có phát sinh dòng điện
Câu 16:
Metyl axetat: CH3COOCH3
Etyl fomat: HCOOC2H5
Metyl fomat: HCOOCH3
Etyl axetat: CH3COOC2H5
Câu 18:
Các axit mạnh như: HCl, HNO3, HClO4, H2SO4.
Các bazơ mạnh như NaOH, KOH, Ba(OH)2 và hầu hết các muối.
Câu 19:
NaHCO3 không tạo kết tủa với dung dịch BaCl2 ở điều kiện thường. Còn lại:
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
NaHSO4 + BaCl2 → BaSO4 + NaCl + HCl
SO3 + H2O + BaCl2 → BaSO4 + 2HCl
Câu 20:
Phân tử peptit bắt đầu bằng đầu N (còn nhóm NH2) và kết thúc bằng đầu C (còn nhóm COOH)
Câu 21:
CH3OH + CuO → HCHO + Cu + H2O
Nhận xét: Cứ 1 mol CH3OH mất đi lại được thay thế bằng 1 mol H2O → Lượng H2 thoát ra khi cho X + Na giống như cho CH3OH ban đầu + Na
→
→ V = 0,42 lít
Câu 22:
→ nC2H5OH = nCO2 = 0,1 mol .
Câu 23:
nAncol = nC4H8O2 = 0,1
→ Mancol = 60: C3H7OH
→ X là HCOOC3H7
Câu 25:
X gồm 2 kim loại là Ag và Cu
Y chỉ chứa một muối → Fe(NO3)2
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Câu 27:
(a) Nhiệt phân Mg(HCO3)2
(b) Nhiệt phân KNO3
(c) Cho Ba vào dung dịch CuSO4 dư
(d) Cho Al vào dung dịch FeCl2
(e) Cho hơi nước đi qua than nóng đỏ
(g) Điện phân dung dịch NaCl không màng ngăn.
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm thu được đơn chất là
(a) Mg(HCO3)2 → MgO + 2CO2 + H2O
(b) 2KNO3 → 2KNO2 + O2
(c) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2
(d) 2Al + 3FeCl2 → 2AlCl3 + 3Fe
(e) H2O + C → CO + H2
2H2O + C → CO2 + 2H2
(g) NaCl + H2O → NaClO + H2
Câu 28:
(a) Do có tính sát trùng, fomon được dùng để bảo quản các mẫu động vật.
(b) Mỡ lợn có chứa chất béo bão hòa (phân tử có các gốc hiđrocacbon no) là chủ yếu.
(c) Quá trình chuyển hóa tinh bột trong cơ thể người có xảy ra phản ứng thủy phân.
(d) Khi làm đậu phụ từ sữa đậu nành có xảy ra sự đông tụ protein.
(e) Các chất polietilen, cao su thiên nhiên sẽ nhanh hỏng khi giặt rửa chúng trong xà phòng. Số phát biểu đúng là
Chỉ có (e) sai, các polime này bền trong môi trường kiềm yếu của xà phòng.
Câu 29:
|
Chất |
X |
Y |
Z |
T |
|
AgNO3/NH3, t° |
- |
Ag↓ |
- |
Ag↓ |
|
Cu(OH)2 |
Không tan |
Xanh lam |
Xanh lam |
Xanh lam |
|
Br2 |
↓ trắng |
Mất màu |
Không mất màu |
Không mất màu |
T có tráng gương nên loại B. T không làm mất màu Br2 nên loại A, D → Chọn C.
C6H5NH2 + 3Br2 C6H2Br3NH2 + 3HBr
Br2 + C6H12O6 + H2O → 2HBr + C6H12O7
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu + 2H2O
2AgNO3 + H2O + 2NH3 + C6H12O6 → 2Ag + 2NH4NO3 + C6H12O7
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
Câu 30:
a. Polistiren có cấu trúc mạch phân nhánh.
b. Tơ nilon-6,6 điều chế bằng phản ứng trùng hợp.
c. Hầu hết polime là những chất rắn, không có nhiệt độ nóng chảy xác định.
d. Cao su isopren có thể tham gia phản ứng với HCl.
e. Poliacrylonitrin có tính đàn hồi, tính dẻo và có khả năng kéo sợi.
Số phát biểu đúng là
(a) Sai, polistiren có cấu trúc mạch không phân nhánh.
(b) Sai, tơ nilon-6,6 điều chế bằng phản ứng trùng ngưng
(c) Đúng
(d) Đúng, do cao su còn nối đôi C=C
(e) Sai, poliacrylonitrin không có tính đàn hồi và tính dẻo.
Câu 31:
Bước 1: Nhỏ vài giọt anilin vào ống nghiệm chứa 5 ml nước cất, lắc đều, sau đó để yên. Bước 2: Nhỏ tiếp dung dịch HCl (đặc) dư vào ống nghiệm.
Bước 3: Cho tiếp dung dịch NaOH (loãng) đến dư, đồng thời đun nóng. Cho các phát biểu sau:
a. Kết thúc bước 1, nhúng quỳ tím vào dung dịch thấy quỳ tím không đổi màu.
b. Kết thúc bước 2, thu được dung dịch đồng nhất.
c. Kết thúc bước 3, thu được dung dịch trong suốt.
d. Ở bước 1, anilin hầu như không tan, tạo vẩn đục và lắng xuống đáy.
e. Ở thí nghiệm trên, nếu thay anilin bằng metylamin thì hiện tượng thí nghiệm tương tự. Số phát biểu đúng là
(a) Đúng, anilin có tính bazơ nhưng rất yếu, không làm đổi màu quỳ tím
(b) Đúng, do tạo muối tan:
C6H5NH2 + HCl → C6H5NH3Cl
(c) Sai, hỗn hợp phân lớp do tạo anilin ít tan:
C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O
(d) Đúng
(e) Sai, metylamin tan tốt nên tất cả các bước đều trong suốt.
Câu 33:
Trong phản ứng cháy:
Bảo toàn khối lượng → m chất béo = 17,72 g
Bảo toàn O → n chất béo = 0,02 mol
→ M chất béo = 886
Trong phản ứng với NaOH:
n chất béo = 7,088/886 = 0,008
→ nNaOH = 0,024 và nC3H5(OH)3 = 0,008
Bảo toàn khối lượng → m xà phòng = 7,312 gam
Câu 37:
Thí nghiệm 1: Hấp thụ hết 0,56 lít khí CO2 (đktc) vào 500 ml dung dịch X gồm KOH 0,1x (mol/lít) và Ba(OH)2 0,2y (mol/lít), thu được 3,94 gam kết tủa.
Thí nghiệm 2: Hấp thụ hết 0,56 lít khí CO2 (đktc) vào 500 ml dung dịch Y gồm KOH 0,1y (mol/lít) và Ba(OH)2 0,2x (mol/lít), thu được 0,985 gam kết tủa.
Biết cả hai thí nghiệm, dung dịch sau phản ứng đều tác dụng với dung dịch NaOH. Giá trị x + y là
Dung dịch sau phản ứng đều tác dụng với dung dịch NaOH → Chứa HCO3- → OH- hết
TN1: 0,025 mol CO2 + KOH (0,05x) và Ba(OH)2 (0,1y) → nBaCO3 = 0,02 mol
TN2: 0,025 mol CO2 + KOH (0,05y) và Ba(OH)2 (0,1x) → nBaCO3= 0,005 mol
TH1: Dung dịch sau phản ứng cả 2TN đều không còn CO32-. Áp dụng:
nOH- = 2nCO32- + nHCO3-
0,05x + 2.0,1y = 0,02.2 + (0,025 – 0,02)
0,05y + 2.0,1x = 0,005.2 + (0,025 – 0,005)
→ x = 0,1; y = 0,2
→ x + y = 0,3
TH2: Dung dịch sau phản ứng cả hai thí nghiệm đều còn CO32-.
→ Ba2+ đã kết tủa hết
→ 0,1y = 0,02 và 0,1x = 0,005 → x = 0,05; y = 0,2
→ nOH- = 0,05x + 0,2y = 0,0425
→ nCO32-= 0,0175 mol và nHCO3-= 0,0075 mol
nCO32- < nBaCO3 nên loại trường hợp này.
Câu 38:
Quy đổi Y (b mol) thành CH2 (a) và H2 (b)
nO2 = 1,5a + 0,5b = 0,275 và nCO2 = a = 0,15
→ b = 0,1 → mY = 2,3
nC4H10 ban đầu = nY = 0,1 mol
Bảo toàn khối lượng:
m tăng = mAnken = mC4H10 ban đầu – mY = 3,5 gam
Câu 39:
nY = nX = 0,5; nNaOH = 0,7 → Trong Y chứa este đơn chức và đa chức.
X + H2 → Y chứa 2 este nên trong X có 2 chất có cùng số C và số O.
Muối có tráng bạc là HCOONa, ancol cùng C nên ít nhất 3C → Các chất trong X ít nhất 4C
nCO2 - nH2O = nX nên X có k trung bình = 2
Số C =
TH1:
A là HCOO-CH2-C≡CH (0,15 mol)
B là HCOO-CH2-CH2-CH3 (0,15 mol) C là (HCOO)2C3H6 (0,2 mol)
Loại do không thỏa mãn nB > nC
TH2:
A là HCOO-CH2-CH=CH2 (0,3 mol)
B là HCOO-CH2-CH2-CH3 (0,1 mol)
C là (HCOO)3C3H5 (0,1 mol)
Loại do không thỏa mãn nB > nC
TH3:
A là HCOO-CH2-C≡CH (0,15 mol)
B là HCOO-CH2-CH2-CH3 (0,25 mol) C là (HCOO)3C3H5 (0,1 mol)
Nghiệm thỏa mãn nB > nC
→ = 2nA = 0,3 và %B = 42,15%
Câu 40:
Hoà tan 2,64 gam hỗn hợp bột gồm Fe3O4 và Cu (tỉ lệ mol tương ứng là 2 : 1) trong dung dịch HCl vừa đủ, thu được dung dịch X. Cho toàn bộ X tác với dung dịch chứa 0,11 mol AgNO3, thu được kết tủa Y, dung dịch Z. Đem điện phân dung dịch Z với cường độ dòng điện không đổi 5A. Đồ thị biểu diễn về độ giảm khối lượng dung dịch Z với thời gian t như sau:
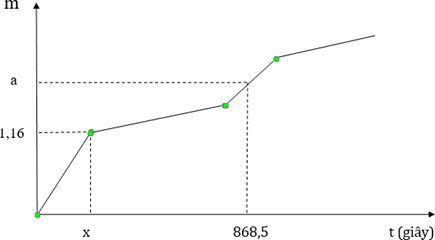
Giá trị của a và x lần lượt là
nFe3O4 = 0,01 và nCu = 0,005
→ X chứa FeCl3 (0,01), FeCl2 (0,02), CuCl2 (0,005)
nAgNO3 = 0,11 > nCl- + nFe2+ = 0,1 nên Z chứa Ag+ dư (0,01), Fe3+ (0,03), Cu2+ (0,005) và NO3- (0,1)
Đoạn 1: Catot có nAg = 0,01 và anot có = 0,0025
ne = 0,01 = → x = 193s
Đoạn 3:
Khi t = 868,5 → ne = 0,045
Catot: ne = nAg+ + nFe3+ + 2nCu2+ bị điện phân
→ nCu2+ bị điện phân = 0,0025
Anot: = 0,01125
→ a = 0,01.108+ 0,0025.64 + 0,01125.32 = 1,6 gam
