Đề thi thử THPT môn Hóa năm 2022 có đáp án (Mới nhất) - Đề 2
-
3792 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Este nào sau đây có khả năng tham gia phản ứng tráng bạc?
Xem đáp án
Đáp án đúng là: D
Các este có khả năng tham gia phản ứng tráng bạc là các este có chứa gốc axit fomic. (HCOO-)
Các este có khả năng tham gia phản ứng tráng bạc là các este có chứa gốc axit fomic. (HCOO-)
Câu 2:
Muối mononatri của amino axit nào sau đây được dùng làm bột ngọt (mì chính)?
Xem đáp án
Đáp án đúng là: B
Muối mononatri của amino axit được dùng làm bột ngọt là axit glutamic.
Axit glutamic có công thức: HOOCCH2CH2CH(NH2)COOH
Muối mononatri của amino axit được dùng làm bột ngọt là axit glutamic.
Axit glutamic có công thức: HOOCCH2CH2CH(NH2)COOH
Câu 3:
Kim loại dẫn điện tốt nhất là
Xem đáp án
Đáp án đúng là: D
Ag là kim loại dẫn điện tốt nhất; ghi nhớ thêm thứ tự dẫn điện: Ag > Cu > Au > Al > Fe.
Ag là kim loại dẫn điện tốt nhất; ghi nhớ thêm thứ tự dẫn điện: Ag > Cu > Au > Al > Fe.
Câu 4:
Trùng hợp monome nào sau đây thu được polime dùng để sản xuất thủy tinh hữu cơ?
Xem đáp án
Đáp án đúng là: D
Trùng hợp monome dùng để sản xuất thủy tinh hữu cơ là metyl metacrylat.
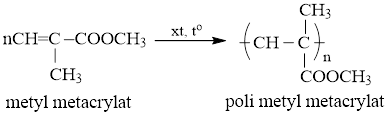
Trùng hợp monome dùng để sản xuất thủy tinh hữu cơ là metyl metacrylat.
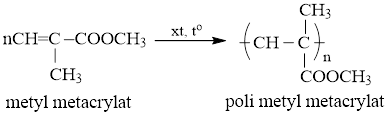
Câu 5:
Số nhóm –OH trong mỗi mắt xích của xenlulozơ là
Xem đáp án
Đáp án đúng là: A
Số nhóm –OH trong mỗi mắt xích của xenlulozơ là 3.
Xenlulozơ là một polime hợp thành từ các mắt xích β- glucozơ nối với nhau bởi các liên kết β -1,4-glicozit
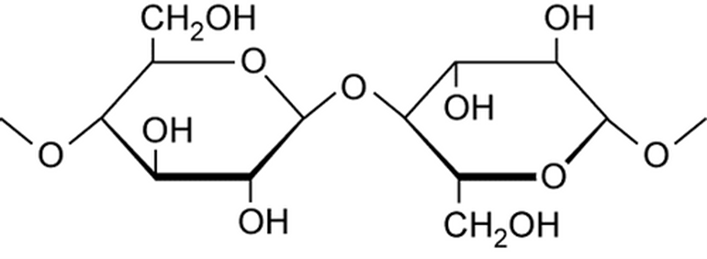
Mỗi mắt xích C6H10O5 có 3 nhóm OH tự do, nên có thể viết công thức cấu tạo của xenlulozơ là [C6H7O2(OH)3]n
Số nhóm –OH trong mỗi mắt xích của xenlulozơ là 3.
Xenlulozơ là một polime hợp thành từ các mắt xích β- glucozơ nối với nhau bởi các liên kết β -1,4-glicozit

Mỗi mắt xích C6H10O5 có 3 nhóm OH tự do, nên có thể viết công thức cấu tạo của xenlulozơ là [C6H7O2(OH)3]n
Câu 6:
Hai dung dịch đều tác dụng được với Fe là
Xem đáp án
Đáp án đúng là: D
Hai dung dịch đều tác dụng được với Fe là CuSO4 và HCl:
Fe + CuSO4 → FeSO4 + Cu
Fe + 2HCl → FeCl2 + H2
Còn lại CaCl2, ZnCl2, MgCl2 không tác dụng với Fe.
Hai dung dịch đều tác dụng được với Fe là CuSO4 và HCl:
Fe + CuSO4 → FeSO4 + Cu
Fe + 2HCl → FeCl2 + H2
Còn lại CaCl2, ZnCl2, MgCl2 không tác dụng với Fe.
Câu 7:
Tên gọi của C2H5COOC2H5 là:
Xem đáp án
Đáp án đúng là: B
Tên gọi của C2H5COOC2H5 là etyl propionat.
Công thức tương ứng với các tên gọi còn lại là:
Metyl propionat: C2H5COOCH3
Etyl axetat: CH3COOC2H5
Metyl axetat: CH3COOCH3
Tên gọi của C2H5COOC2H5 là etyl propionat.
Công thức tương ứng với các tên gọi còn lại là:
Metyl propionat: C2H5COOCH3
Etyl axetat: CH3COOC2H5
Metyl axetat: CH3COOCH3
Câu 8:
Dung dịch nào sau đây làm đổi màu quỳ tím?
Xem đáp án
Đáp án đúng là: B
Anilin có tính bazơ yếu, phenol có tính axit yếu, glyxin có số nhóm -COOH bằng số nhóm -NH2, nên dung dịch của chúng đều không làm đổi màu quỳ tím.
Glyxin: H2NCH2COOH
Lysin số nhóm -COOH nhỏ hơn số nhóm -NH2, dung dịch lysin làm quỳ tím hóa xanh.
Lysin: (H2N)2C5H9COOH
Anilin có tính bazơ yếu, phenol có tính axit yếu, glyxin có số nhóm -COOH bằng số nhóm -NH2, nên dung dịch của chúng đều không làm đổi màu quỳ tím.
Glyxin: H2NCH2COOH
Lysin số nhóm -COOH nhỏ hơn số nhóm -NH2, dung dịch lysin làm quỳ tím hóa xanh.
Lysin: (H2N)2C5H9COOH
Câu 9:
Cho dãy các kim loại: K, Mg, Na, Al. Kim loại có tính khử mạnh nhất trong dãy là
Xem đáp án
Đáp án đúng là: C
Tính khử của các kim loại giảm dần theo dãy: K > Na > Mg > Al
Tính khử của các kim loại giảm dần theo dãy: K > Na > Mg > Al
Câu 10:
Trong các ion sau đây, ion nào có tính oxi hóa yếu nhất?
Xem đáp án
Đáp án đúng là: B
Tính oxi hóa: Ag+ > Cu2+ > Fe3+ > H+.
Tính oxi hóa: Ag+ > Cu2+ > Fe3+ > H+.
Câu 11:
Chất nào sau đây không phản ứng được với dung dịch FeCl2?
Xem đáp án
Đáp án đúng là: C
Cu không phản ứng được với dung dịch FeCl2.
Còn lại:
2FeCl2 + Cl2 → 2FeCl3
4H+ + NO3- + 3Fe2+ → 3Fe3+ + NO + 2H2O
2OH- + Fe2+ → Fe(OH)2
Cu không phản ứng được với dung dịch FeCl2.
Còn lại:
2FeCl2 + Cl2 → 2FeCl3
4H+ + NO3- + 3Fe2+ → 3Fe3+ + NO + 2H2O
2OH- + Fe2+ → Fe(OH)2
Câu 12:
Chất nào sau đây thuộc loại đisaccarit?
Xem đáp án
Đáp án đúng là: A
Glucozơ: monosaccarit
Tinh bột, xenlulozơ: polisaccarit
Glucozơ: monosaccarit
Tinh bột, xenlulozơ: polisaccarit
Câu 13:
Anilin không có tính chất nào sau đây?
Xem đáp án
Đáp án đúng là: C
C sai, anilin nặng hơn H2O.
C sai, anilin nặng hơn H2O.
Câu 14:
Số liên kết peptit có trong phân tử Gly-Ala-Val-Lys (mạch hở) là:
Xem đáp án
Đáp án đúng là: D
Peptit có 4 mắt xích a-amino axit, giữa 2 a-amino axit kế tiếp nhau hình thành một liên kết peptit → Peptit có tổng cộng 4 - 1=3 liên kết peptit.
Peptit có 4 mắt xích a-amino axit, giữa 2 a-amino axit kế tiếp nhau hình thành một liên kết peptit → Peptit có tổng cộng 4 - 1=3 liên kết peptit.
Câu 15:
Tơ nào sau đây thuộc loại tơ nhân tạo?
Xem đáp án
Đáp án đúng là: B
- Tơ xenlulozơ axetat thuộc loại tơ nhân tạo.
- Tơ nilon-6,6 và tơ olon thuộc loại tơ tổng hợp.
- Tơ tằm thuộc loại tơ thiên nhiên.
- Tơ xenlulozơ axetat thuộc loại tơ nhân tạo.
- Tơ nilon-6,6 và tơ olon thuộc loại tơ tổng hợp.
- Tơ tằm thuộc loại tơ thiên nhiên.
Câu 16:
Phân tử khối của Lysin là:
Xem đáp án
Đáp án đúng là: C
Lysin: (H2N)2C5H9COOH
Phân tử khối của Lysin là 146.
Lysin: (H2N)2C5H9COOH
Phân tử khối của Lysin là 146.
Câu 17:
Thực hiện các thí nghiệm sau:
(1) Cho lá kim loại Fe nguyên chất vào dung dịch CuSO4.
(2) Cho lá kim loại Al nguyên chất vào dung dịch HNO3.
(3) Đốt cháy dây Mg nguyên chất trong khí Cl2.
(4) Cho lá kim loại Fe-Cu vào dung dịch H2SO4 loãng.
Số thí nghiệm xảy ra ăn mòn hóa học là
(1) Cho lá kim loại Fe nguyên chất vào dung dịch CuSO4.
(2) Cho lá kim loại Al nguyên chất vào dung dịch HNO3.
(3) Đốt cháy dây Mg nguyên chất trong khí Cl2.
(4) Cho lá kim loại Fe-Cu vào dung dịch H2SO4 loãng.
Số thí nghiệm xảy ra ăn mòn hóa học là
Xem đáp án
Đáp án đúng là: B
(1) Thỏa mãn: ban đầu Fe bị ăn mòn hóa học: Fe + CuSO4 → FeSO4 + Cu↓.
Cu sinh ra bám trực tiếp lên Fe ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(2) Không thỏa vì Al bị thụ động trong HNO3 đặc, nguội.
(3) Thỏa mãn vì Mg + Cl2 MgCl2.
(4) Không thỏa vì Fe bị ăn mòn điện hóa.
(1) Thỏa mãn: ban đầu Fe bị ăn mòn hóa học: Fe + CuSO4 → FeSO4 + Cu↓.
Cu sinh ra bám trực tiếp lên Fe ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(2) Không thỏa vì Al bị thụ động trong HNO3 đặc, nguội.
(3) Thỏa mãn vì Mg + Cl2 MgCl2.
(4) Không thỏa vì Fe bị ăn mòn điện hóa.
Câu 18:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi lại trong bảng sau
Các dung dịch X, Y, Z, T lần lượt là
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Nước Br2 |
Kết tủa trắng |
|
Y |
Dung dịch AgNO3 trong NH3 đun nóng |
Kết tủa Ag trắng sáng |
|
Z |
Quỳ tím |
Chuyển màu hồng |
|
T |
Cu(OH)2 |
Có màu tím |
Các dung dịch X, Y, Z, T lần lượt là
Xem đáp án
Đáp án đúng là: B
X + Br2 tạo kết tủa trắng → Loại A
Y có tráng gương → Loại D
Z làm quỳ tím chuyển hồng → Loại C
→ Chọn B
X + Br2 tạo kết tủa trắng → Loại A
Y có tráng gương → Loại D
Z làm quỳ tím chuyển hồng → Loại C
→ Chọn B
Câu 19:
Thực hiện các thí nghiệm sau:
(a) Đốt bột nhôm nguyên chất trong không khí.
(b) Ngâm thanh thép vào dung dịch giấm ăn.
(c) Ngâm thanh đồng nguyên chất vào dung dịch FeCl3.
(d) Cho lá kẽm nguyên chất vào dung dịch chứa H2SO4 và CuSO4.
Các thí nghiệm không xảy ra ăn mòn điện hóa là
(a) Đốt bột nhôm nguyên chất trong không khí.
(b) Ngâm thanh thép vào dung dịch giấm ăn.
(c) Ngâm thanh đồng nguyên chất vào dung dịch FeCl3.
(d) Cho lá kẽm nguyên chất vào dung dịch chứa H2SO4 và CuSO4.
Các thí nghiệm không xảy ra ăn mòn điện hóa là
Xem đáp án
Đáp án đúng là: D
(a) Không xảy ra ăn mòn điện hóa vì không có hai điện cực khác nhau về bản chất và không có dung dịch điện li.
(b) Xảy ra ăn mòn điện hóa. Hai điện Fe và C tiếp xúc với nhau và cùng tiếp xúc với dung dịch giấm ăn.
(c) Không xảy ra ăn mòn điện hóa vì không có hai điện cực khác nhau về bản chất. Tính khử của Cu yếu hơn Fe nên không khử được Fe3+ về Fe.
(d) Xảy ra ăn mòn điện hóa vì có phản ứng tạo Cu
Zn + Cu2+ → Zn2+ + Cu
Vậy hai thí nghiệm không xảy ra ăn mòn điện hóa là (a) và (c).
(a) Không xảy ra ăn mòn điện hóa vì không có hai điện cực khác nhau về bản chất và không có dung dịch điện li.
(b) Xảy ra ăn mòn điện hóa. Hai điện Fe và C tiếp xúc với nhau và cùng tiếp xúc với dung dịch giấm ăn.
(c) Không xảy ra ăn mòn điện hóa vì không có hai điện cực khác nhau về bản chất. Tính khử của Cu yếu hơn Fe nên không khử được Fe3+ về Fe.
(d) Xảy ra ăn mòn điện hóa vì có phản ứng tạo Cu
Zn + Cu2+ → Zn2+ + Cu
Vậy hai thí nghiệm không xảy ra ăn mòn điện hóa là (a) và (c).
Câu 20:
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
Xem đáp án
Đáp án đúng là: D
2Al + 6HCl → 2AlCl3 + 3H2
nH2= 0,15 mol
→ nAl = = 0,1 mol
→ %Al = = 54%
2Al + 6HCl → 2AlCl3 + 3H2
nH2= 0,15 mol
→ nAl = = 0,1 mol
→ %Al = = 54%
Câu 21:
Phương trình hóa học nào sau đây sai?
Xem đáp án
Đáp án đúng là: A
Cu là kim loại hoạt động hóa học yếu, không tác dụng với HCl ở điều kiện thường.
Cu là kim loại hoạt động hóa học yếu, không tác dụng với HCl ở điều kiện thường.
Câu 22:
Khi đốt cháy hoàn toàn một polime X chỉ thu được CO2 và hơi nước với tỉ lệ số mol tương ứng là 1 : 1. X có thể là polime nào dưới đây?
Xem đáp án
Đáp án đúng là: A
Khi đốt cháy hoàn toàn một polime X chỉ thu được CO2 và hơi nước với tỉ lệ số mol tương ứng là 1 : 1
→ X có số H = 2.số C, có thể có thêm O.
→ X là Polipropilen (-CH2-CH(CH3)-)n
Khi đốt cháy hoàn toàn một polime X chỉ thu được CO2 và hơi nước với tỉ lệ số mol tương ứng là 1 : 1
→ X có số H = 2.số C, có thể có thêm O.
→ X là Polipropilen (-CH2-CH(CH3)-)n
Câu 23:
Cho dãy các tơ sau: xenlulozơ axetat, capron, nitron, visco, nilon-6, nilon-6,6. Số tơ trong dãy thuộc loại tơ poliamit là
Xem đáp án
Đáp án đúng là: A
Các tơ poliamit trong dãy: capron, nilon-6, nilon-6,6.
Các tơ poliamit trong dãy: capron, nilon-6, nilon-6,6.
Câu 24:
Thủy phân 0,1 mol saccarozơ trong môi trường axit (hiệu suất 80%), thu được dung dịch X. Trung hòa dung dịch X, thu được dung dịch Y. Cho dung dịch Y tác dụng hoàn toàn với lượng dự dung dịch AgNO3 trong NH3 (đun nóng), khối lượng Ag thu được là:
Xem đáp án
Đáp án đúng là: D
C12H22O11 → 2C6H12O6 → 4Ag
0,1 → 0,4
→ mAg = 0,4.108.80% = 34,56 gam
C12H22O11 → 2C6H12O6 → 4Ag
0,1 → 0,4
→ mAg = 0,4.108.80% = 34,56 gam
Câu 25:
Cho các polime: PVC, cao su lưu hóa, amilopectin, poli(metyl metacrylat), nilon-7. Số polime có cấu trúc mạch không phân nhánh là
Xem đáp án
Đáp án đúng là: B
Các polime có cấu trúc mạch không phân nhánh là:
PVC, poli(metyl metacrylat), nilon-7.
Các polime có cấu trúc mạch không phân nhánh là:
PVC, poli(metyl metacrylat), nilon-7.
Câu 26:
Để thu được 59,4 gam xenlulozơ trinitrat cần phải lấy bao nhiêu mol HNO3, biết hiệu suất phản ứng đạt 80%?
Xem đáp án
Đáp án đúng là: A
[C6H7O2(OH)3]n + 3nHNO3 → [C6H7O2(ONO2)3]n + 3nH2O
= 0,2 mol
→ = = 0,75 mol
[C6H7O2(OH)3]n + 3nHNO3 → [C6H7O2(ONO2)3]n + 3nH2O
= 0,2 mol
→ = = 0,75 mol
Câu 27:
Cho hỗn hợp gồm Al và Fe vào dung dịch chứa Cu(NO3)2 và FeCl3, sau phản ứng hoàn toàn thu được chất rắn X gồm hai kim loại và dung dịch Y chứa hai muối. Cation kim loại có trong dung dịch Y là
Xem đáp án
Đáp án đúng là: B
X gồm hai kim loại là Fe và Cu.
Y chứa hai muối là Al(NO3)3 và AlCl3
→ Cation trong Y là Al3+
X gồm hai kim loại là Fe và Cu.
Y chứa hai muối là Al(NO3)3 và AlCl3
→ Cation trong Y là Al3+
Câu 28:
Cho 8,85 gam trimetylamin tác dụng vừa đủ với dung dịch HCl, khối lượng muối thu được là
Xem đáp án
Đáp án đúng là: A
nHCl = n (CH3)3N= 0,15 (mol)
→ m muối = m (CH3)3N + mHCl = 14,325 (g)
Câu 29:
Cho 2,88 gam Mg vào 200 ml dung dịch chứa FeCl2 0,3M và CuCl2 0,4M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
Xem đáp án
Đáp án đúng là: C
nMg = 0,12 mol; nFeCl2 = 0,06 mol; nCuCl2 = 0,08 mol
→ Dung dịch sau phản ứng chứa Cl- (0,28), Mg2+ (0,12), bảo toàn điện tích
→ nFe2+ = 0,02
→ Chất rắn gồm Cu (0,08) và Fe (0,06 – 0,02 = 0,04)
→ m rắn = 7,36 (g)
nMg = 0,12 mol; nFeCl2 = 0,06 mol; nCuCl2 = 0,08 mol
→ Dung dịch sau phản ứng chứa Cl- (0,28), Mg2+ (0,12), bảo toàn điện tích
→ nFe2+ = 0,02
→ Chất rắn gồm Cu (0,08) và Fe (0,06 – 0,02 = 0,04)
→ m rắn = 7,36 (g)
Câu 30:
Cho 2,52 gam kim loại M tác dụng với dung dịch H2SO4 loãng vừa đủ, sau phản ứng thu được 6,84 gam muối sunfat trung hòa. Kim loại M là
Xem đáp án
Đáp án đúng là: B
= 0,045 mol
Kim loại M hóa trị x. Bảo toàn electron:
2,52 = 0,045.2 → M = 28x
→ x = 2 và M = 56: M là Fe
= 0,045 mol
Kim loại M hóa trị x. Bảo toàn electron:
2,52 = 0,045.2 → M = 28x
→ x = 2 và M = 56: M là Fe
Câu 31:
Cho 6,75 gam một amin đơn chức X (bậc 2) tác dụng hết với dung dịch HCl vừa đủ thu được dung dịch chứa 12,225 gam muối clorua. Công thức cấu tạo của X là
Xem đáp án
Đáp án đúng là: C
nX = nHCl = = 0,15
→ MX = 45: C2H7N
X là amin bậc 2 nên có cấu tạo: CH3-NH-CH3
nX = nHCl = = 0,15
→ MX = 45: C2H7N
X là amin bậc 2 nên có cấu tạo: CH3-NH-CH3
Câu 32:
Thủy phân hoàn toàn 44,3 gam triglixerit X trong dung dịch KOH vừa đủ, thu được m gam glixerol và 48,1 gam muối. Giá trị của m là
Xem đáp án
Đáp án đúng là: B
nC3H5(OH)3= x → nKOH = 3x
Bảo toàn khối lượng:
44,3 + 56.3x = 48,1 + 92x → x = 0,05
nC3H5(OH)3= x → nKOH = 3x
Bảo toàn khối lượng:
44,3 + 56.3x = 48,1 + 92x → x = 0,05
mC3H5(OH)3 → = 4,6 gam
Câu 33:
Tiến hành lên men 108 gam glucozơ, thu được ancol etylic và V lít khí CO2 (đktc). Hấp thụ hoàn toàn lượng CO2 sinh ra vào 1 lít dung dịch NaOH 1M, thu được dung dịch chỉ chứa 77,8 gam hỗn hợp muối. Hiệu suất quá trình lên men là
Xem đáp án
Đáp án đúng là: A
Muối gồm Na2CO3 (a) và NaHCO3 (b)
→ m muối = 106a + 84b = 77,8
nNaOH = 2a + b = 1
→ a = 0,1; b = 0,8
→ nCO2 = a + b = 0,9
→ nCO6H12O6 phản ứng = 0,45
→ H = = 75%
Muối gồm Na2CO3 (a) và NaHCO3 (b)
→ m muối = 106a + 84b = 77,8
nNaOH = 2a + b = 1
→ a = 0,1; b = 0,8
→ nCO2 = a + b = 0,9
→ nCO6H12O6 phản ứng = 0,45
→ H = = 75%
Câu 34:
Hỗn hợp G gồm glyxin và axit glutamic. Cho 3,69 gam hỗn hợp G vào 100 ml dung dịch HCl 0,5M được dung dịch Z. Dung dịch Z phản ứng vừa đủ với 100 ml dung dịch KOH 1M. Thành phần phần trăm theo khối lượng của glyxin và axit glutamic trong hỗn hợp G lần lượt là:
Xem đáp án
Đáp án đúng là: B
Đặt a, b là số mol của Gly và Glu
→ mG = 75a + 147b = 3,69
nHCl = 0,05
nKOH = a + 2b + 0,05 = 0,1
→ a = 0,01; b = 0,02
→ Gly (20,33%) và Glu (79,67%)
Đặt a, b là số mol của Gly và Glu
→ mG = 75a + 147b = 3,69
nHCl = 0,05
nKOH = a + 2b + 0,05 = 0,1
→ a = 0,01; b = 0,02
→ Gly (20,33%) và Glu (79,67%)
Câu 35:
Hòa tan hoàn toàn 10,1 gam hỗn hợp X gồm Mg, Al và Zn trong 2 lít dung dịch HNO3 xM, sau phản ứng thu được dung dịch Y chỉ chứa 48,02 gam muối và thoát ra 1,792 lít NO (đktc) duy nhất. Giá trị của x là
Xem đáp án
Đáp án đúng là: B
nNO = 0,08 mol; nNH4+ = y mol; nHNO3 = 2x mol
→ nH+ = 2x = 0,08.4 + 10y (1)
m muối = 10,1 + 62(0,08.3 + 8y) + 80y = 48,02 gam (2)
Giải hệ (1) và (2)
→ x = 0,36; y = 0,04
nNO = 0,08 mol; nNH4+ = y mol; nHNO3 = 2x mol
→ nH+ = 2x = 0,08.4 + 10y (1)
m muối = 10,1 + 62(0,08.3 + 8y) + 80y = 48,02 gam (2)
Giải hệ (1) và (2)
→ x = 0,36; y = 0,04
Câu 36:
Thủy phân hoàn toàn 0,15 mol este đơn chức X bằng dung dịch KOH vừa đủ, thu được 36,6 gam hỗn hợp Y gồm hai muối. Mặt khác, đốt cháy hoàn toàn 3 gam X cần vừa đủ a mol O2. Giá trị của a là
Xem đáp án
Đáp án đúng là: B
nKOH = 2nX = 0,3 mol; nH2O = nX = 0,15 mol
Bảo toàn khối lượng → mX = 22,5 gam
→ MX = 150: C9H10O2
→ nO2 = 0,21 mol
nKOH = 2nX = 0,3 mol; nH2O = nX = 0,15 mol
Bảo toàn khối lượng → mX = 22,5 gam
→ MX = 150: C9H10O2
→ nO2 = 0,21 mol
Câu 37:
Cho hỗn hợp X gồm muối A (C5H16O3N2) và B (C4H12O4N2) tác dụng với một lượng dung dịch NaOH vừa đủ, đun nóng đến khi phản ứng xảy ra hoàn toàn rồi cô cạn thu được m gam hỗn hợp Y gồm hai muối D và E (MD < ME) và 4,48 lít hỗn hợp Z gồm hai amin no, đơn chức đồng đẳng kế tiếp có tỉ khối hơi đối với H2 là 18,3. Khối lượng của muối E trong hỗn hợp Y là
Xem đáp án
Đáp án đúng là: C
(C2H5NH3)2CO3 + NaOH → 2Na2CO3 + 2C2H5NH2 + 2H2O
(COONH3-CH3)2 + 2NaOH → (COONa)2 + 2CH3NH2 + 2H2O
Khí Z gồm C2H5NH2 (0,08 mol) và CH3NH2 (0,12 mol)
E là muối (COONa)2 (0,06 mol)
→ mE = 8,04 gam
(C2H5NH3)2CO3 + NaOH → 2Na2CO3 + 2C2H5NH2 + 2H2O
(COONH3-CH3)2 + 2NaOH → (COONa)2 + 2CH3NH2 + 2H2O
Khí Z gồm C2H5NH2 (0,08 mol) và CH3NH2 (0,12 mol)
E là muối (COONa)2 (0,06 mol)
→ mE = 8,04 gam
Câu 38:
Cho các mệnh đề sau:
(a) Thủy phân este trong môi trường kiềm được gọi là phản ứng xà phòng hóa.
(b) Trimetyl amin là một amin bậc ba.
(c) Có thể dùng Cu(OH)2 để phân biệt Ala-Ala và Ala-Ala-Ala.
(d) Tơ nilon-6,6 được điều chế từ phản ứng trùng hợp bởi hexametylenđiamin và axit ađipic.
(e) Chất béo lỏng khó bị oxi hóa bởi oxi không khí hơn chất béo rắn.
(f) Cao su là loại vật liệu polime có tính đàn hồi.
Số mệnh đề đúng là
(a) Thủy phân este trong môi trường kiềm được gọi là phản ứng xà phòng hóa.
(b) Trimetyl amin là một amin bậc ba.
(c) Có thể dùng Cu(OH)2 để phân biệt Ala-Ala và Ala-Ala-Ala.
(d) Tơ nilon-6,6 được điều chế từ phản ứng trùng hợp bởi hexametylenđiamin và axit ađipic.
(e) Chất béo lỏng khó bị oxi hóa bởi oxi không khí hơn chất béo rắn.
(f) Cao su là loại vật liệu polime có tính đàn hồi.
Số mệnh đề đúng là
Xem đáp án
Đáp án đúng là: B
(a) Đúng
(b) Đúng
(c) Đúng, (Ala)3 cho màu tím, (Ala)2 không có màu tím.
(d) Sai, phản ứng trùng ngưng
(e) Sai, chất béo lỏng chứa C=C, dễ bị oxi hóa hơn.
(f) Đúng
(a) Đúng
(b) Đúng
(c) Đúng, (Ala)3 cho màu tím, (Ala)2 không có màu tím.
(d) Sai, phản ứng trùng ngưng
(e) Sai, chất béo lỏng chứa C=C, dễ bị oxi hóa hơn.
(f) Đúng
Câu 39:
Hòa tan hoàn toàn m gam hỗn hợp gồm Fe, Fe3O4, FeS (trong đó nguyên tố oxi chiếm 12,5% về khối lượng) trong dung dịch chứa a mol KNO3 và 0,43 mol H2SO4 (loãng), sau phản ứng thu được khí NO (sản phẩm khử duy nhất của N+5 và dung dịch Y. Cho dung dịch Y phản ứng vừa đủ với 740 ml dung dịch KOH 1M, thu được 21,4 gam kết tủa và dung dịch Z chứa 101,14 gam hỗn hợp muối. Giá trị của a là:
Xem đáp án
Đáp án đúng là: D
Z chứa hỗn hợp muối nên Y còn NO3- dư.
Dễ thấy
nKOH = 0,74 > nên trong Y có H+ dư.
→ Kết tủa là Fe(OH)3 (0,2 mol)
→ nH+ dư = 0,74 – 0,2.3 = 0,14 mol
Hỗn hợp ban đầu quy đổi thành Fe (0,2), S (b) và O (c). Đặt nNO = d
→ mO = 16c = 12,5%(0,2.56 + 32b + 16c) (1)
Bảo toàn electron: 0,2.3 + 6b = 2c + 3d (2)
Y chứa Fe3+ (0,2), H+ (0,14), K+ (a), SO42- (b + 0,43), NO3- (a – d)
Bảo toàn điện tích:
0,2.3 + 0,14 + a = 2(b + 0,43) + (a – d) (3)
m muối trong Z = 39(a + 0,74) + 96(b + 0,43) + 62(a – d) = 101,14 (4)
(1), (2), (3), (4) → a = 0,4; b = 0,07; c = 0,12; d = 0,26
Z chứa hỗn hợp muối nên Y còn NO3- dư.
Dễ thấy
nKOH = 0,74 > nên trong Y có H+ dư.
→ Kết tủa là Fe(OH)3 (0,2 mol)
→ nH+ dư = 0,74 – 0,2.3 = 0,14 mol
Hỗn hợp ban đầu quy đổi thành Fe (0,2), S (b) và O (c). Đặt nNO = d
→ mO = 16c = 12,5%(0,2.56 + 32b + 16c) (1)
Bảo toàn electron: 0,2.3 + 6b = 2c + 3d (2)
Y chứa Fe3+ (0,2), H+ (0,14), K+ (a), SO42- (b + 0,43), NO3- (a – d)
Bảo toàn điện tích:
0,2.3 + 0,14 + a = 2(b + 0,43) + (a – d) (3)
m muối trong Z = 39(a + 0,74) + 96(b + 0,43) + 62(a – d) = 101,14 (4)
(1), (2), (3), (4) → a = 0,4; b = 0,07; c = 0,12; d = 0,26
Câu 40:
Cho hai muối X, Y thỏa mãn điều kiện sau:
(1) X + Y → không xảy ra phản ứng.
(2) X + Cu → không xảy ra phản ứng.
(3) Y + Cu → không xảy ra phản ứng
(4) X + Y + Cu → xảy ra phản ứng.
Hai muối X và Y thỏa mãn là
(1) X + Y → không xảy ra phản ứng.
(2) X + Cu → không xảy ra phản ứng.
(3) Y + Cu → không xảy ra phản ứng
(4) X + Y + Cu → xảy ra phản ứng.
Hai muối X và Y thỏa mãn là
Xem đáp án
Đáp án đúng là: A
X là NaHSO4 và Y là NaNO3, X và Y không phản ứng với nhau và đều không phản ứng với Cu, nhưng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
X là NaHSO4 và Y là NaNO3, X và Y không phản ứng với nhau và đều không phản ứng với Cu, nhưng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
