25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề 5)
-
3506 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
Câu 2:
Đáp án B.
Một số chất béo thường gặp:
- Tripanmitin:
- Tristearin:
- Triolein:
- Triliolein:
Câu 4:
Hỗn hợp X gồm hai chất: và . Trong đó, Y là muối của amin, Z là muối của axit đa chức. Cho 29,4 gam X tác dụng với dung dịch NaOH dư đun nóng, thu được 0,4 mol khí và m gam muối. Giá trị của m là
Đáp án A.
.
Câu 5:
Đáp án C
PTHH: 2NaCl + 2H2O 2NaOH + Cl2 + H2.
Câu 7:
Đáp án C
Khí amoniac tan tốt trong nước tạo môi trường bazơ làm quỳ tím hóa xanh.
Câu 8:
Thành phần chính của quặng hematit là
Đáp án A
Thành phần chính của một số loại quặng:
Manhetit (Fe3O4), hematit (Fe2O3), pirit (FeS2), xiderit (FeCO3), photphorit (Ca3(PO4)2), apatit 3Ca3(PO4)2.CaF2), đolomit (CaCO3.MgCO3), florit (CaF2), manhezit (MgCO3),…
Câu 9:
Đáp án B
CT của poli metyl metacrylat (thủy tinh hữu cơ):
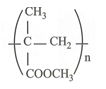
Câu 10:
Dung dịch muối không phản ứng với Fe là
Đáp án C
Dãy hoạt động hóa học của kim loại:
Theo quy tắc α thì Fe sẽ phản ứng được với AgNO3, CuSO4, FeCl3.
Câu 11:
Đáp án D
Glucozơ và fructozơ tác dụng được với H2 tạo thành sobitol.
Nhóm chức –CHO và =CO của glucozơ và fructozơ bị khử trở thành –CH2-OH và –CH-OH.
Câu 12:
Khi đun nóng hỗn hợp 2 ancol CH3OH và C2H5OH (xúc tác H2SO4 đặc, nhiệt độ ) thì số ete thu được tối đa là
Đáp án C
3 ete thu được là: CH3OCH3, CH3OC2H5, C2H5OC2H5Câu 13:
Đáp án A
Câu 14:
Cho 1,24 gam hỗn hợp Na, K tan hoàn toàn trong 2 lít H2O thấy thoát ra 0,448 lít khí (đktc) và thu được dung dịch X. Thành phần phần trăm khối lượng của K trong hỗn hợp đầu là
Đáp án B
2M + 2H2O →2MOH + H2
Ta có:
Câu 15:
Cho các chất sau: glucozơ, anđehit fomic, anđehit axetic, axit fomic, axetilen, benzen. Số chất tác dụng được với AgNO3/NH3 là
Đáp án C
Những chất tác dụng được với AgNO3/NH3: glucozơ, anđehit fomic, anđehit axetic, axit fomic, axetilen.
Câu 16:
Cho 50ml dung dịch glucozơ tác dụng với một lượng dư AgNO3 trong NH3 thu được 1,08 gam Ag kết tủa. Nồng độ mol của dung dịch glucozơ đã dùng là
Câu 17:
Đốt cháy hoàn toàn một amin đơn chức X, thu được 8,4 lít khí CO2, 1,4 lít khí N2 (đo ở điều kiện tiêu chuẩn) và 10,125 gam H2O. Công thức phân tử của X là
Đáp án C
Câu 18:
Nung hợp chất hữu cơ X với lượng dư CuO thấy thoát ra khí CO2, hơi H2O và khí N2. Kết luận nào sau đây đúng?
Đáp án A
Vì sản phẩm cháy chứa CO2, H2O, N2 nên chắc chắn X chứa C, H, N. Nhưng ban đầu nung X với CuO chứa O nên sản phẩm đốt chứa O không chứng minh được trong X có O.
Câu 19:
Cho các dung dịch sau đây có cùng nồng độ: HCl (1), NaOH (2), H2SO4 (3), KNO3 (4). Dung dịch có pH lớn nhất là
Đáp án B
Dung dịch NaOH có pH>7.
Dung dịch H2SO4, HCl có pH<7.
Dung dịch KNO3 có pH = 7.
- Dung dịch có tính bazơ có pH>7, dung dịch có tính axit có pH<7, dung dịch trung tính có pH =7.
- Tính bazơ càng mạnh thì pH càng lớn, tính axit càng mạnh thì pH càng nhỏ.
Câu 20:
Cho một số tính chất sau: (1) polisaccarit, (2) tinh thể không màu, (3) khi thủy phân tạo thành glucozơ và fructozơ, (4) tham gia phản ứng tráng gương, (5) phản ứng với Cu(OH)2. Những tính chất nào là của saccarozo?
Đáp án B
(1) Saccarozo là đisaccarit.
(4) Saccarozo không tham gia phản ứng tráng gương.
Câu 21:
Trường hợp nào sau đây không xảy ra hiện tượng ăn mòn điện hóa học?
Đáp án D
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4 Ở trường hợp này không thỏa mãn điều kiện có 2 điện cực (chỉ có 1 điện cực Cu) nên không có hiện tượng ăn mòn điện hóa học.
Câu 22:
Số trieste của glixerol chứa đồng thời 3 gốc axit C15H31COOH, C17H35COOH và C17H33COOH là
Đáp án C
C15H31COO CH2 C15H31COO CH2 C17H33COOCH2
C17H33COO CH C17H31COO CH C15H31COOCH
C17H31COO CH2 C17H33COO CH2 C17H31COOCH2
Câu 23:
Cho các phát biểu sau:
(a) Khi đốt cháy hoàn toàn một hidrocacbon X bất kì, nếu thu được số mol CO2 lớn hơn số mol H2O thì X là ankin.
(b) Trong thành phần hợp chất hữu cơ nhất thiết phải có cacbon.
(c) Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
(d) Những hợp chất hữu cơ khác nhau có cùng phân tử khối là đồng phân của nhau.
(e) Phản ứng hữu cơ thường xảy ra nhanh và không theo một hướng nhất định.
(g) Hợp chất C9H14BrCl có vòng benzen trong phân tử.
Số phát biểu đúng là
Đáp án D
Những phát biểu đúng: (b), (c).
(a) Sai vì X có thể là ankin, ankadien, đồng đẳng benzen,…
(d) Sai vì HCOOH và C2H5OH.
(e) Sai vì phản ứng hữu cơ thường xảy ra chậm và không theo hướng xác định.
(g) Sai vì hợp chất C9H14BrCl có k = 2 thì mà muốn có vòng benzen
Câu 24:
Phản ứng nào sau đây không đúng?
Đáp án C
3Fe3O4 + 28HNO3 (1) → 9Fe(NO3)3 + NO + 14H2O
Câu 25:
Nhiệt phân hoàn toàn 16,2 gam Ca(HCO3)2 thu được V(lít) khí CO2. Giá trị của V là
Đáp án A
Ca(HCO3)2 CaO + 2CO2 + H2O
Nhiệt phân hủy muối cacbonat trung hòa và muối axit:
- Muối axit bị nhiệt phân tạo thành muối trung hòa, khí cacbonic và hơi nước.
- Chỉ có muối trung hòa không tan mới bị nhiệt phân tạo oxit, khí cacbonic và hơi nước.
Câu 26:
Xà phòng hóa hoàn toàn 15,3 gam este đơn chức cần vừa đủ 200ml dung dịch NaOH xM. Sau khi phản ứng xảy ra hoàn toàn thu được 16,5 gam muối của axit cacboxylic. Giá trị của x là
Đáp án B
Nhận thấy, khối lượng muối sau phản ứng lớn hơn khối lượng este nên đây là tạo thành từ ancol metylic (CH3OH).
Giải thích:
RCOOR’ → RCOONa
Khi thay gốc OR’ bằng gốc ONa thì khối lượng muối lớn hơn, chứng tỏ nên R’ chỉ có thể là CH3(15).
RCOOCH3 → RCOONa
Câu 27:
Đáp án D
A sai vì đây là phản ứng một chiều.
B sai vì có những este khi thủy phân trong NaOH thu được muối, anđehit, xeton, nước.
C sai vì este isoamyl axetat có mùi chuối chín.Câu 28:
Thí nghiệm nào sau đây không xảy ra phản ứng?
Đáp án D
H3PO4 là axit yếu hơn HNO3 nên không thể đẩy gốc axit mạnh ra khỏi muối.
Câu 29:
Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị m là
Đáp án A
Fe + 2HCl →FeCl2 + H2
Đối với bài toán kim loại tác dụng với HCl, H2SO4, nếu các kim loại trong hỗn hợp đều tác dụng với axit thì sử dụng phương pháp bảo toàn khối lượng sẽ nhanh hơn, nhưng cần lưu ý đối với hỗn hợp kim loại có kim loại không tác dụng với HCl, H2SO4 loãng thì không áp dụng bảo toàn khối lượng được vì lúc này lượng muối tính ra sẽ không chính xác vì khối lượng khi bảo toàn đã bao gồm khối lượng kim loại không tác dụng tạo muối.
Câu 30:
Hỗn hợp E có khối lượng 17,75 gam gồm Al, Ca, Al4C3 và CaC2. Hòa tan hoàn toàn E vào nước thu được dung dịch F trong suốt và hỗn hợp khí G. Đốt cháy toàn bộ G thu được 5,6 lít CO2 (đktc) và 10,35 gam H2O. Thêm 500ml dung dịch HCl 1M vào F thu được m gam kết tủa. Giá trị của m là
Đáp án B
BT C:
BTNT O:
BT e:
Câu 31:
Cho Na tác dụng hết với 500ml dung dịch HCl 1M, kết thúc thí nghiệm thu được 8,96 lít khí (đktc) và dung dịch X. Cô cạn X thu được m gam chất rắn. Giá trị của m là
Đáp án B
2Na + 2HCl → 2NaCl + H2
0,5 → 0,25
Nên Na phản ứng với nước trong dung dịch.
2Na + 2H2O → 2NaOH + H2
Nhầm lẫn thường xảy ra trong cách giải bài toán này là quên đi phản ứng giữa natri và nước, dẫn đến khó khăn trong việc nhận định số mol khí hiđro là do 2 phản ứng tạo thành.
Cần nắm chắc kiến thức về tính chất của kim loại kiềm: vừa tác dụng với axit vừa tác dụng với nước nhưng phản ứng với axit xảy ra trước, nếu kim loại sau khi phản ứng với axit còn dư thì phản ứng với nước.
Câu 32:
(a) Axit axetic và axit propionic tan vô hạn trong nước.
(b) Dung dịch Axit α-amino isovaleric làm quỳ tím hóa đỏ.
(c) Đồng phân cấu tạo là các hợp chất hữu cơ có cùng công thức phân tử nhưng có cấu tạo hóa học khác nhau.
(d) Các ancol đều có đồng phân mạch cacbon và đồng phân vị trí nhóm chức.
(e) Axit aminocaproic và axit aminoenantoic đều có khả năng tham gia phản ứng trùng ngưng tạo polime.
(g) Trùng hợp là quá trình kết hợp nhiều phân tử nhỏ (monome) giống nhau hay tương tự nhau thành phân tử rất lớn (polime).
Số phát biểu đúng là
Đáp án A
Những phát biểu đúng: (a), (c), (e), (g).
(a) Đúng: axit fomic, axit axetic và axit propionic tan vô hạn trong nước.
(b) Sai vì axit α-amino isovaleric còn gọi là valin, là amino axit có 1 NH2 và 1 COOH nên không làm đổi màu quỳ tím.
(d) Sai vì ancol có từ 1-3 C thì không có đồng phân mạch cacbon, ancol có từ 1-2 C thì không có đồng phân vị trí nhóm chức.
Câu 33:
Tiến hành điện phân 100ml dung dịch hỗn hợp Cu(NO3)2 xM, Fe(NO3)3 0,3M, H2SO4 aM với điện cực trơ, cường độ dòng điện I = 19,3(A). Sau thời gian t giây, ở catot bắt đầu thoát khí thì dừng điện phân, dung dịch sau điện phân hòa tan hết 8,4 gam Fe thu được dung dịch chỉ chứa một muối và khí NO (là sản phẩm khử duy nhất). Tổng các giá trị t thỏa mãn là
Đáp án B
BT e:
Dung dịch sau điện phân hòa tan hết Fe thu được dung dịch chỉ chứa 1 muối
Nếu dung dịch sau chỉ chứa muối FeSO4
Nếu dung dịch sau chỉ chứa muối Fe2(SO4)3
Vậy tổng giá trị t thỏa mãn 700 (s).
Ở bài toán này, khi đề bài đề cập đến thời gian t là lúc catot bắt đầu thoát khí, thì khi đó chính là khí H2 khi axit điện phân, tránh nhầm lẫn với sự điện phân nước ở catot, và lúc đó thì chỉ mới điện phân tạo thành
Câu 34:
Hỗn hợp E chứa hai este mạch hở gồm este X và este Y Đốt cháy hoàn toàn 13,89 gam hỗn hợp E chứa X và Y cần dùng 0,6975 mol O2. Mặt khác đun nóng 13,89 gam E cần dùng 165 ml dung dịch NaOH 1M thu được một ancol duy nhất và hỗn hợp chứa a gam muối A và b gam muối B . Tỉ lệ gần nhất của a : b là
Đáp án A
Từ (1) và (2):
Thay vào (1)
Câu 35:
Cho từ từ dung dịch Ba(OH)2 0,5M vào 500ml dung dịch AlCl3 xM và Al2(SO4)3 yM thì khối lượng kết tủa thu được phụ thuộc thể tích dung dịch Ba(OH)2 theo đồ thị sau:
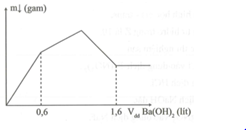
Tỉ lệ x : y là
Đáp án B
Giai đoạn 1: Đồ thị dốc chứng tỏ lượng kết tủa tăng nhanh: Al2(SO4)3 tác dụng với Ba(OH)2.
Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3 + H2O
0,5y → 1,5y 1,5y y
Giai đoạn 2: AlCl3 tác dụng với Ba(OH)2
2AlCl3 + 3Ba(OH)2 → 2Al(OH)3 + 3 BaCl2
0,5x 0,75x 0,5x
Giai đoạn 3: Al(OH)3 tác dụng với NaOH
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
(0,5x+y) →(0,25x+0,5y)
Câu 36:
Bước 1: Nhỏ vài giọt anilin vào ống nghiệm chứa 10ml nước cất, lắc đều, sau đó để yên.
Bước 2: Nhỏ tiếp dung dịch HCl đặc vào ống nghiệm.
Bước 3: Nhỏ tiếp dung dịch NaOH loãng (dùng dư) vào ống nghiệm, đun nóng.
Cho các nhận định sau:
(a) Kết thúc bước 1, nhúng quỳ tím vào thấy quỳ tím không đổi màu.
(b) Ở bước 2 thì anilin tan dần.
(c) Kết thúc bước 3, thu được dung dịch trong suốt.
(d) Ở bước 1, anilin hầu như không tan, nó tạo vẩn đục và lắng xuống đáy.
Số nhận định đúng là
Đáp án B
Những phát biểu đúng: (a), (b), (d).
(a) Đúng. Dung dịch anilin có tính bazơ nhưng không làm đổi màu quỳ tím.
(b) Đúng. C6H5NH2 + HCl → C6H5NH3Cl
(c) Sai vì C6H5NH3Cl + NaOH → C6H5NH2 + NaCl + H2O nên dung dịch vẩn đục.
(d) Đúng.
Câu 37:
Hòa tan hết 14,88 gam hỗn hợp gồm Mg, Fe3O4, Fe(NO3)2 vào dung dịch chứa 0,58 mol HCl, sau khi các phản ứng kết thúc thu được dung dịch X chứa 30,05 gam chất rắn và thấy thoát ra 1,344 lít (đktc) hỗn hợp khí Y gồm H2, NO, NO2 có tỷ khối so với H2 bằng 14. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Z, 84,31 gam kết tủa và thấy thoát ra 0,244 lít (đktc) khí NO là sản phẩm khử duy nhất của . Phần trăm khối lượng của Mg trong hỗn hợp ban đầu gần nhất với
Đáp án B
BT H:
BT N:
BT Fe:
Để xác định đúng các ion trong dung dịch X cần nắm các ý sau:
- Dung dịch X tác dụng với AgNO3 có khí NO chứng tỏ trong X còn ion
- Đề bài không đề cập đến sản phẩm khử duy nhất của chứng tỏ có thể có ion .
- Hỗn hợp khí Y chứa H2, chứng tỏ kim loại đã tác dụng với , vậy trong Y không còn ion .
- và có thể không đủ để cùng đưa Fe lên số oxi hóa cao nhất.
Câu 38:
Hỗn hợp E gồm axit no, đơn chức X, axit đa chức Y (phân tử chứa ba liên kết mạch không phân nhánh) đều mạch hở và este Z (chỉ chứa nhóm chức este) tạo bởi ancol đa chức T với X và Y. Đốt cháy hoàn toàn 14,93 gam E cần dùng vừa đủ 0,3825 mol O2. Mặt khác, 14,93 gam E phản ứng tối đa với 260ml dung dịch NaOH 1M thu được m gam ancol T. Đốt cháy hoàn toàn m gam ancol T thu được 1,98 gam CO2 và 1,08 gam H2O. Nhận xét nào sau đây sai?
Đáp án D
Vì Z tạo bởi X đơn chức, Y đa chức và Z chỉ chứa nhóm chức este, mà T có 3C. Nên T có công thức C3H8O3 và Y là axit 2 chức không no có 1 liên kết .
Xem hỗn hợp E gồm:
Vậy E gồm:
D sai vì Z có 10 hiđro.
Câu 39:
Thực hiện các thí nghiệm sau
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(b) Cho FeS vào dung dịch HCl.
(c) Cho Si vào dung dịch NaOH đặc.
(d) Cho dung dịch AgNO3 vào dung dịch NaF.
(e) Cho Si vào bình chứa khí F2.
(f) Sục khí SO2 vào dung dịch H2S.
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng là
Đáp án D
(a)
(b)
(c)
(e)
(f)
Câu 40:
Cho hỗn hợp Z gồm peptit mạch hở X và amino axit Y với tỉ lệ mol tương ứng 1:1. Cho m gam Z tác dụng vừa đủ với dung dịch NaOH, thu được dung dịch T chứa (m+12,24) gam hỗn hợp muối natri của glyxin và alanin. Dung dịch T phản ứng tối đa với 360ml dung dịch HCl 2M, thu được dung dịch chứa 63,72 gam hỗn hợp muối. Các phản ứng xảy ra hoàn toàn. Kết luận nào sau đây đúng?
Đáp án D
BTKL:
Vậy hỗn hợp Z có thể là: hoặc
Nhưng nên hỗn hợp Z là:
A sai. Tỉ lệ số gốc Gly : Ala trong phân tử X là 2:3.
B sai. Số liên kết peptit trong phân tử X là 4.
C sai. Phần trăm khối lượng nitơ trong Y là 18,67%.
D đúng.
