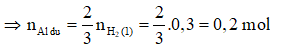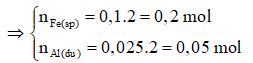Bài tập phản ứng nhiệt nhôm chọn lọc, có đáp án
-
916 lượt thi
-
14 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Trộn 8,1 gam Al và 48 gam rồi cho tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm thu được m gam hỗn hợp rắn. Giá trị của m là
Theo định luật bảo toàn khối lượng ta có:
⇔ 8,1 + 48 = 56,1 =
⇒ Chọn A.
Câu 2:
Dùng m gam Al để khử hoàn toàn một lượng sau phản ứng thấy khối lượng oxit giảm 0,58g. Hỏi lượng nhôm đã dùng là
2Al + → + 2Fe
2a………a……a…….mol
Theo bài ta có
= 0,58g
⇔ 160a - 102a = 0,58g
⇔ 58a = 0,58
⇔ a = 0,01 mol
⇒ = 2a = 0,02 mol
⇒ = 0,02.27 = 0,54g
⇒ Chọn C.
Câu 3:
Hỗn hợp X gồm và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm:
Theo bài, ta giả sử số mol của là 1 mol, của Al là 3 mol.
8Al + 3→ 4 + 9Fe
Ban đầu 3…………1………........……mol
Ta có vậy Al còn dư sau phản ứng.
Vậy sau phản ứng hỗn hợp gồm có Al dư, , Fe.
⇒ Chọn D.
Câu 4:
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn Y. Cho Y tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol . Mặt khác nếu cho Y tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol . Số mol Al trong X là
Vì Y tác dụng với NaOH sinh ra khí nên có Al còn dư → phản ứng hết.
Vậy Y gồm có Al dư, và Fe.
- Y tác dụng với NaOH sinh khí .
- Y tác dụng với HCl sinh khí .
2Al + 6HCl → +3 (2)
Fe + 2HCl → + (3)
⇒ n(2) = = 3/2 . 0,2 = 0,3 mol
⇒ n(3) = = - n(2)
= 0,4 - 0,3 = 0,1 mol
- Phản ứng nhiệt nhôm:
2Al + → + 2Fe (4)
Theo phản ứng (4) ta có:
= 0,2 + 0,1 = 0,3 mol
⇒ Chọn A.
Câu 5:
Nung m gam hỗn hợp Al, đến phản ứng hoàn toàn thu được hỗn hợp rắn Y. Chia Y làm 2 phần bằng nhau. Phần 1 tác dụng với dung dịch loãng dư, sinh ra 3,08 lít khí ở đktc. Phần 2 tác dụng với dung dịch NaOH dư, sinh ra 0,84 lít khí ở đktc. Giá trị của m là
Theo bài ra phản ứng xảy ra hoàn toàn, phần 2 tác dụng với NaOH sinh ra khí Y có Al dư.
Vậy rắn Y gồm , Fe và Al dư.
Xét phần 2:
2Al + 2NaOH + → (1)
0,025 ← 0,0375 mol
Xét phần 1:
2Al + 3 → + (2)
0,025 → 0,0375 mol
Fe + → + (3)
0,1 ← 0,1375 - 0,0375 mol
Phản ứng nhiệt nhôm:
0,2 0,1 ← 0,2 mol
= 0,1.160 + 0,2.27 + 0,05.27 = 22,75g
⇒ Chọn D.
Câu 6:
Hỗn hợp X gồm Al, có khối lượng 21,67 gam. Tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ xảy ra phản ứng khử thành Fe). Hòa tan hỗn hợp chất rắn sau phản ứng bằng dung dịch NaOH dư thu được 2,016 lít khí (đktc) và 12,4 gam chất rắn không tan. Hiệu suất của phản ứng nhiệt nhôm là
Phản ứng nhiệt nhôm:
2Al + + 2Fe
Bài toán có hiệu suất phản ứng chưa hoàn toàn.
Vậy hỗn hợp rắn sau phản ứng gồm: Fe, , Al (dư) và (dư)
Chất rắn phản ứng với NaOH có .
Theo định luật bảo toàn khối lượng, ta có:
Xét phản ứng:
Giả sử phản ứng hoàn toàn thì Al sẽ dư
→ Tính hiệu suất phản ứng nhiệt nhôm theo .
⇒ H = = 75%
⇒ Chọn D.
Câu 7:
Khi nung hoàn toàn hỗn hợp A gồm x gam Al và y gam thu được hỗn hợp B. Chia B thành hai phần bằng nhau:
+ Phần 1 cho tác dụng với dung dịch NaOH dư, không có khí thoát ra và còn lại 4,4 gam chất rắn không tan.
+ Phần 2 cho tác dụng với dung dịch loãng, dư thu được 1,12 lít khí(đktc).
Giá trị của y là
Phản ứng nhiệt nhôm:
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí → hỗn hợp B không có Al dư. Vậy hỗn hợp B gồm , Fe và có thể có dư.
4,4 gam chất rắn không tan có thể gồm Fe và
Phần 2: tác dụng với loãng dư → chỉ có Fe phản ứng sinh ra khí
Khối lượng dư ở phần 2 được tính = 4,4 – mFe = 4,4 – 0,05.56 = 1,6 gam.
Khối lượng ban đầu: 0,05.160 + 1,6.2 = 11,2 gam.
⇒ Chọn B.
Câu 8:
Nung Al và (không có không khí, phản ứng xảy ra hoàn toàn) thu được hỗn hợp A. Nếu cho A tác dụng với dung dịch KOH dư thì thu được 0,672 lít khí (đktc). Nếu cho A tác dụng với đặc, nóng dư được 1,428 lít SO2 duy nhất (đktc). % khối lượng Al trong hỗn hợp ban đầu là:
Số mol = 1,5x + 0,03 = 0,06375→ x = 0,0225 mol
⇒ Chọn C.
Câu 9:
Có 3 lọ không nhãn, mỗi lọ đựng một trong các chất rắn sau: Cu, Mg, Al. Thuốc thử để nhận biết 3 chất trên là:
Đáp án A
Để nhận biết 3 chất rắn trên thì ta dùng lần lượt dung dịch NaOH và HCl.
- Cho dung dịch NaOH vào 3 ống nghiệm đựng chất rắn, chất rắn nào tan và sủi bọt khí là Al, 2 ống không hiện tượng là Cu và Mg
PTHH: 2Al + 2NaOH + 2↑
- Cho dung dịch HCl vào 2 chất rắn còn lại, chất rắn nào tan và sủi bọt khí là Mg, chất rắn không hiện tượng là Cu
PTHH: Mg + 2HCl → ↑
Câu 11:
Chỉ dùng 1 chất để phân biệt 3 kim loại sau: Al, Ba, Mg?
Đáp án B
Để phân biệt 3 kim loại Al, Ba, Mg ta dùng nước. Cho nước vào 3 mẫu kim loại, kim loại tốt trong nước và sủi bọt khí là Ba, 2 kim loại không tan trong nước là Al và Mg.
Ba + ↑
- Lấy dung dịch Ba(OH)2 vừa thu được đổ vào mẫu 2 kim loại còn lại, kim loại nào tan, sủi bọt khí là Al, kim loại không có hiện tượng gì là Mg
2Al +
Câu 12:
Cho các phát biểu về phản ứng nhiệt nhôm, phát biểu đúng là
Đáp án B
Phát biểu đúng là: Nhôm chỉ có thể khử các oxit kim loại đứng sau Al trong dãy hoạt động hóa học.
Câu 13:
Cho các kim loại: Cu, Zn, Fe, Mg, Ag, Al. Những kim loại nào không tác dụng với dd đặc nguội?
Đáp án C
2 kim loại không phản ứng với dung dịch đặc nguội là Fe và Al
Câu 14:
Khi điện phân nóng chảy người ta thêm criolit () với mục đích:
1. Làm hạ nhiệt độ nóng chảy của .
2. Làm cho tính dẫn điện cao hơn.
3. Để thu được ở anot thay vì là .
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Các lý do nêu đúng là:
Đáp án D
Khi điện phân nóng chảy người ta thêm criolit () với mục đích:
1. Làm hạ nhiệt độ nóng chảy của .
2. Làm cho tính dẫn điện cao hơn.
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.