Bộ đề thi thử môn Hóa THPT Quốc gia năm 2022 có lời giải (30 đề)
Bộ đề thi thử THPT Quốc gia năm 2022 môn Hóa có lời giải (Đề 19)
-
2865 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Cho một miếng Zn vào cốc đựng dung dịch H2SO4 loãng. Bọt khí H2 sẽ bay ra nhanh hơn khi thêm vào cốc trên dung dịch nào trong các dung dịch sau?
Câu 3:
Phương trình hóa học nào sau đây không đúng
Câu 5:
Etyl fomat có mùi đặc trưng của đào chín và cũng là thành phần trong hương vị của quả mâm xôi, táo. Etyl fomat được sử dụng làm chất tạo hương vị. Công thức của etyl format là
Câu 6:
Trong các kim loại kiềm sau, kim loại có nhiệt độ nóng chảy lớn nhất là
Câu 7:
Cho chất X vào dung dịch NaOH dư, sau phản ứng thu được dung dịch chỉ chứa NaAlO2 và NaOH dư. X không thể là chất nào sau đây?
Câu 9:
Khoáng vật đolomit được dùng làm đồ trang trí, làm xi măng. Đolomit đôi khi được dùng làm phụ gia trong luyện kim. Lượng lớn đolomit được dùng trong sản xuất thủy tinh. Đolomit còn là một loại đá trữ dầu quan trọng. Thành phần hóa học chính của đolomit là.
Câu 10:
Khí nào sau đây là một trong những nguyên nhân gây ra hiện tượng mưa axit?
Câu 11:
Kim loại nào sau đây điều chế được bằng phương pháp điện phân dung dịch?
Câu 14:
Glyxin là chất rắn kết tinh không màu, có vị ngọt, được tìm thấy trong gelatin, sợi tơ tằm và được sử dụng như một chất dinh dưỡng. Glyxin cũng là một chất dẫn truyền thần kinh ức chế nhanh. Tổng số nguyên tử các nguyên tố trong glyxin là
Câu 16:
Ở điều kiện thường amin X là chất lỏng, không màu, dễ bay hơi. X là chất nào trong các chất sau?
Câu 17:
"Nước đá khô” không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Thành phần của nước đá khô là
Câu 19:
Một cốc nước có chứa các ion: Na+ (0,03 mol); Mg2+ (0,02 mol); Ca2+ (0,04 mol); Cl- (0,02 mol), HCO![]() (0,11 mol) và SO
(0,11 mol) và SO![]() (0,01 mol). Đun sôi cốc nước cho đến khi các phản ứng xảy ra hoàn thì nước còn lại trong cốc
(0,01 mol). Đun sôi cốc nước cho đến khi các phản ứng xảy ra hoàn thì nước còn lại trong cốc
Chọn D.
Khi đun sôi:
nên và chưa kết tủa hết.
Nước còn lại trong cố là nước cứng vĩnh cửu.
Câu 20:
Cho 0,5 ml dung dịch chất X vào ống nghiệm, sau đó nhỏ tiếp từng giọt nước brom đồng thời lắc nhẹ ống nghiệm, thấy xuất hiện kết tủa trắng. Chất X là
Chọn D.
Chất X là phenol:
Câu 22:
Để khử hoàn toàn m gam Fe2O3 ở nhiệt độ cao cần dùng vừa đủ 13,44 lít khí CO (ở đktc). Khối lượng sắt thu được sau phản ứng là
Chọn A.
gam
Câu 23:
Amin X có chứa vòng benzen, phản ứng với dung dịch HCl thì thu được muối có công thức dạng C7H7NH3Cl. Số đồng phân của X thỏa mãn tính chất trên là
Chọn C.
nên X là amin bậc 1
Các đồng phân bậc 1, chứa vòng benzene của X:
Câu 25:
Phát biểu nào sau đây là đúng?
Câu 26:
X và Y là hai cacbohiđrat. X là chất kết tinh, không màu, dễ tan trong nước, có vị ngọt hơn đường mía. Phân tử Y gồm nhiều gốc β-glucozơ liên kết với nhau. Tên gọi của X và Y lần lượt là
Chọn B.
X là chất kết tinh, không màu, dễ tan trong nước, có vị ngọt hơn đường mía là fructozơ.
Phân tử Y gồm nhiều gốc glucozơ liên kết với nhau là xenlulozơ.
Câu 27:
Cho 5,73 gam hỗn hợp X gồm Mg, Al, Zn ở dạng bột tác dụng với khí oxi thu được 8,13 gam hỗn hợp Y gồm các oxit. Để hòa tan hết Y cần vừa đủ 300 ml dung dịch gồm HCl 0,5M và H2SO4 aM. Giá trị của a là
Chọn C.
Bảo toàn
Câu 28:
Lên men 75,6 gam tinh bột thành ancol etylic với hiệu suất của cả quá trình là h%. Lượng CO2 sinh ra được hấp thụ hoàn toàn vào dung dịch nước vôi trong, thu được 50 gam kết tủa và dịch X. Biết cần thêm tối thiểu 100 ml dung dịch NaOH 1M vào X để thu được lượng kết tủa lớp nhất. Giá trị của h là
Chọn C.
Câu 29:
Thuỷ phân hoàn toàn 6,45 gam este A đơn chức, mạch hở, thu được hai sản phẩm đều có khả năng tham gia phản ứng tráng bạc. Cho toàn bộ sản phẩm phản ứng với lượng dư AgNO3 trong NH3 đun nóng. Sau khi phản ứng xảy ra hoàn toàn thu được 32,4 gam Ag. Công thức cấu tạo của A là
Chọn C.
2 sản phẩm
Các sản phầm thủy phân đều tráng bạc nên A có cấu tạo:
Câu 30:
Dung dịch X gồm NaHCO3 aM và K2CO3 1,2M. Dung dịch Y gồm H2SO4 0,5 M và HCl 1,5M. Nhỏ từ từ đến hết 100 ml dung dịch X vào 100 ml dung dịch Y, thu được 3,36 lít (đktc) khí CO2. Mặt khác, nhỏ từ từ cho đến hết 100 ml dung dịch Y vào 100 ml dung dịch X thu được dung dịch E và V lít khí (đktc). Giá trị của a và V lần lượt là
Chọn D.
X gồm và
Y gồm và
X từ từ vào Y: Đặt phản ứng và phản ứng = 0,12k
và
Y từ từ vào X:
lít
Câu 31:
Cho 5,6 gam bột Fe vào 500 ml dung dịch chứa hai muối AgNO3 aM và Cu(NO3)2 0,1M. Sau một thời gian thu được 9,6 gam chất rắn và dung dịch X. Cho 8,125 gam bột Zn vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn, thu được 9,7375 gam chất rắn và dung dịch Y chỉ chứa một chất tan. Giá trị của a là
Chọn B.
Y chỉ chứa 1 chất tan là - Theo bảo toàn N)
Bảo toàn khối lượng kim loại:
Câu 32:
Thực hiện các thí nghiệm sau:
(a) Sục từ từ khí CO2 đến dư vào dung dịch Ba(OH)2.
(b) Cho dung dịch AgNO3 vào dung dịch FeCl2.
(c) Cho ure vào dung dịch Ca(OH)2.
(d) Cho MgCl2 vào dung dịch Na2S.
(e) Cho AgNO3 vào dung dịch Fe(OH)2 dư.
(f) Cho dung dịch NaHSO4 vào dung dịch Ba(HCO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
Chọn B.
(a) CO2 dư
(b)
(c)
(d)
(e)
(f)
Câu 33:
Hợp chất hữu cơ no, đa chức, mạch hở X có công thức phân tử là C5H8O4. Cho 0,1 mol X tác dụng vừa đủ với 100 gam dung dịch KOH 11,2% thu được chất hữu cơ Y và 21,2 gam hỗn hợp muối. Công thức cấu tạo thu gọn của X là
Chọn A.
Muối gồm và
m muối
là nghiệm duy nhất.
Muối là và
là
Câu 34:
Dung dịch X có pH = 2 gồm HCl và H2SO4 tỉ lệ mol 1 : 2 (coi H2SO4 điện li hoàn toàn cả 2 nấc). Để trung hoà hoàn toàn 0,59 gam hỗn hợp Y gồm 2 amin no, đơn chức, bậc một cần dùng 1 lít dung dịch X. Dung dịch sau phản ứng chứa m gam chất tan. Giá trị của m là
Chọn C.
m chất tan gam.Câu 35:
Điện phân dung dịch chứa m gam hỗn hợp Cu(NO3)2 và NaCl với điện cực trơ, màng ngăn xốp, cường độ dòng điện 2A sau thời gian 4,825 (giờ) thu được dung dịch X và hỗn hợp gồm 2 khí, trong đó khí Cl2 chiếm 40% thể tích. Thêm 375 ml dung dịch HCl 4,4M vào dung dịch X thu được dung dịch Y. Nhúng thanh sắt dư vào Y, khi các phản ứng kết thúc khối lượng thanh sắt giảm 40,8 gam, đồng thời thu được hỗn hợp khí. Biết NO là sản phẩm khử duy nhất của N+5. Giá trị của m là
Chọn B.
TH1: Điện phân thoát ra và
tổng
Ta catot:
Đặt dư ban đầu
Bảo toàn
Đặt
Bảo toàn electron: phản ứng dư
phản ứng
Ban đầu:
TH2: Điện phân thoát ra và (Bạn đọc tự xét).
Câu 36:
Hỗn hợp E gồm ba muối có cùng công thức phân tử là C5H14O4N2. Cho m gam E phản ứng vừa đủ với 200 ml dung dịch KOH 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được 0,12 mol hỗn hợp F gồm ba amin có công thức dạng R(NH2)x (trong đó có 2 amin có cùng số nguyên tử cacbon) và dung dịch G chỉ chứa 19,75 gam ba muối tan có cùng số nguyên tử cacbon. Phần trăm số mol của amin có khối lượng mol lớn nhất trong F là
Chọn D.
3 muối cùng C + 3 amin bậc 1 nên E gồm:
Amin gồm và
Câu 37:
Hòa tan hết m gam hỗn hợp X gồm FeCl2, Mg, Fe(NO3)2 và Al vào dung dịch chứa 0,75 mol HCl thu được dung dịch Y và 2,688 lít khí NO duy nhất ở đktc. Cho từ từ AgNO3 dư vào Y đến phản ứng hoàn toàn thì thấy lượng AgNO3 phản ứng là 0,9525 mol và thu được dung dịch Z chỉ chứa các muối tan; 134,82 gam kết tủa và 0,672 lít khí NO (ở đktc) là sản phẩm khử duy nhất của N+5. Biết % khối lượng Al trong hỗn hợp X là 6,02%. Giá trị của m gần nhất với
Chọn A.
Kết tủa gồm và
và (Bấm hệ và để tính số mol)
Bảo toàn
lần đầu lần sau tổng = 0,15
tổng
có thoát NO nên Y không còn
Bảo toàn lần đầu
Đặt x, y là số mol Mg và Al
Bảo toàn electron tổng
Câu 38:
Cho sơ đồ thí nghiệm ở hình bên và các phát biểu sau:
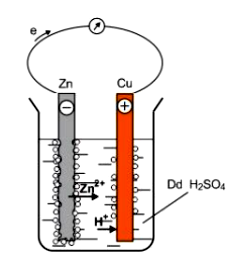
(1) Có dòng electron di chuyển từ thanh đồng sang thanh kẽm ở dãy dẫn ngoài.
(2) Thanh đồng đóng vai trò catot và tại đó xảy ra quá trình oxi hóa ion H+ trong dung dịch.
(3) Phản ứng hóa học xảy ra trong quá trình trên là: Zn + 2H+ → Zn2+ + H2.
(4) Có bọt khí thoát ra ở thanh Cu.
(5) Trong quá trình trên thanh kẽm bị ăn mòn điện hóa và khối lượng thanh kẽm giảm dần.
Số phát biểu đúng là
Chọn C.
(1) Sai, Zn là cực âm nên dòng electron di chuyển từ Zn sang Cu ở dây dẫn ngoài.
(2) Sai, catot Cu xảy ra quá trình khử H+ trong dung dịch.
(3) Đúng
(4) Đúng
(5) Đúng
Câu 39:
Cho các phát biểu sau:
(a) 1 mol Val-Glu phản ứng tối đa với dung dịch chứa 3 mol KOH.
(b) Tơ visco và tơ axetat thuộc loại tơ tổng hợp có nguồn gốc từ xenlulozơ.
(c) Các hợp chất cacbohiđrat còn có tên gọi là saccarit.
(d) Isoamyl axetat là chất lỏng ở điều kiện thường, tan nhiều trong nước.
(e) Ở người bình thường nồng độ glucozơ trong máu giữ ở mức ổn định khoảng 0,01%
(f) Dung dịch phenylamoni clorua có tính axit.
Số phát biểu đúng là
Chọn A.
(a) Đúng:
(b) Sai, đây là 2 tơ bán tổng hợp (nhân tạo)
(c) Đúng
(d) Sai, este này không tan trong nước.
(e) Sai, khoảng 0,1%
(f) Đúng, do
Câu 40:
X, Y là hai axit cacboxylic đều đơn chức, mạch hở (trong phân tử X, Y chứa không quá 2 liên kết π và 50 < MX < MY), Z là este được tạo bởi X, Y và etylen glicol. Oxi hóa hoàn toàn 13,12 gam hỗn hợp E chứa X, Y, Z cần dùng 0,50 mol O2. Nếu đun nóng 13,12 gam E với dung dịch KOH dư đến khi phản ứng hoàn toàn thì số mol KOH phản ứng là 0,20 mol. Mặt khác 0,36 mol E làm mất màu vừa đủ dung dịch chứa 0,10 mol Br2. Phần trăm khối lượng của Z trong E gần nhất với giá trị nào sau đây?
Chọn C.
nên quy đổi E thành:
mol (Tính từ )
mol
mol
Độ không no trung bình
Do nên E không chứa HCOOH, vậy các chức axit đều không phản ứng với Br2.
là
X có C = 2, độ không no = 1 nên Y có C = m, độ không no = 2.
Từ và
Muối gồm và
Z là
