Đề kiểm tra học kì 1 chuyên đề Hóa 9 có đáp án_ đề 4
-
751 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
Đáp án B
SO2 góp phần gây nên mưa axit.
Câu 3:
Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
Đáp án C
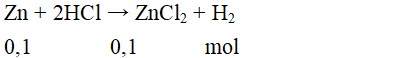
mmuối = 0,1.136 = 13,6 gam.
Câu 4:
Phản ứng nào dưới đây là phản ứng trao đổi ?
Đáp án D
Phản ứng trao đổi: BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 5:
Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
Đáp án D
Fe + CuSO4 → FeSO4 + Cu
Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 6:
Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
Đáp án A
Al tác dụng với NaOH còn Fe thì không.
Câu 7. A
S + O2 → SO2
C + O2 → CO2
4P + 5O2 → 2P2O5
Cl2 và Br2 không tác dụng trực tiếp với O2.
Câu 7:
Dãy phi kim tác dụng với oxi tạo thành oxit axit là:
Đáp án A
S + O2 → SO2
C + O2 → CO2
4P + 5O2 → 2P2O5
Cl2 và Br2 không tác dụng trực tiếp với O2.
Câu 8:
X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố:
Đáp án C
Hợp chất khí có CHỦ ĐỀ: RH3
Theo bài ra: 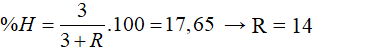
Câu 9:
Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
Dung dịch CuSO4
Kẽm tan một phần, có lớp chất rắn màu đỏ bám vào viên kẽm, dung dịch màu xanh nhạt dần.
PTHH: Zn + CuSO4 → ZnSO4 + Cu↓Câu 10:
Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
Dung dịch HCl
Kẽm tan và có sủi bọt khí.
PTHH: Zn + 2HCl → ZnCl2 + H2↑Câu 11:
Bằng phương pháp hóa học hãy nhận biết dung dịch các chất chứa trong các lọ bị mất nhãn sau: HCl, KOH, NaNO3, Na2SO4
- Lấy mỗi lọ 1 ít dung dịch làm mẫu thử. Cho quỳ tím lần lượt vào từng mẫu thử.
+ Mẫu làm quỳ tím hóa đỏ là dung dịch HCl.
+ Mẫu làm quỳ tím hóa xanh là dung dịch KOH.
+ Mẫu không đổi màu quỳ tím là dung dịch NaNO3 và Na2SO4
- Cho dung dịch BaCl2 lần lượt vào 2 mẫu thử còn lại.
+ Mẫu nào có tạo kết tủa trắng là dung dịch Na2SO4.
PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
+ Mẫu còn lại là NaNO3
Câu 12:
Hãy lập phương trình hóa học của các phản ứng sau:
Al + Cl2 →
Cu + AgNO3 →
Na2O + H2O →
a. 2Al + 3Cl2 → 2AlCl3
b. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
c. Na2O + H2O → 2NaOH
d. FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Câu 13:
Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng?
nNa = 2,3/23 = 0,1 (mol)
2Na + 2H2O → 2NaOH + H2
Theo pt: nNaOH = nNa = 0,1 mol ⇒ mNaOH = 0,1. 40 = 4g
nH2 = (1/2) .nH2 = 0,1 : 2 = 0,05 mol ⇒ mH2 = 2. 0,05 = 0,1 g
mdd sau pư = 2,3 + 97,8 – 0,1 = 100g
C% = (mNaOH/mdd).100% = (4/100).100% = 4%
Câu 14:
Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn .
nH2 = 2,24 / 22,4 = 0,1 mol
Zn + H2SO4 → ZnSO4 + H2
Cu không tác dụng với H2SO4 loãng
Theo pt: nZn = nH2 = 0,1 mol
⇒ mZn = 0,1.65 = 6,5 g
⇒ mCu = 10,5 – 6,5 = 4 g
% mZn = (6,5/10,5).100% = 61,9%
% mCu = 100% - 61,9% = 38,1%
Câu 15:
Hoà tan hoàn toàn 3,25g một kim loại X (hoá trị II) bằng dung dịch HCl thu được 1,12 lít khí H2 (ở đktc). Hãy xác định tên kim loại X ?
X + 2HCl → XCl2 + H2
nH2 = 1,12/22,4 = 0,05 mol
Theo pt: nx = nH2 = 0,05 mol
MX = 3,25/0,05 = 65 g/mol
⇒ X là Zn
Câu 16:
Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Hãy tính khối lượng Ag sinh ra sau phản ứng?
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
1 mol Fe phản ứng tạo thành 2 mol Ag thì khối lượng tăng thêm là: 2.108 – 56 = 160g
Theo bài: m tăng = 57,6 – 56 = 1,6 g
⇒ nFe pư = 1,6/160 = 0,1 mol
nAg = 2.nFe = 0,1.2 = 0,2 mol
mAg = 0,2 .108 = 21,6 g
