Trắc nghiệm tổng hợp Hóa 9 Chương 2: Các loại hợp chất vô cơ có đáp án - Đề 8
-
1106 lượt thi
-
10 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho hỗn hợp A gồm Al, Cu, Fe3O4 vào dung dịch H2SO4 đặc, nóng dư, thu được dung dịch B, khí SO2 thoát ra. Nếu cho hỗn hợp A vào dung dịch HCl dư thu được dung dịch C, chất rắn không tan D và khí E. Cho dung dịch NaOH dư vào dung dịch C thu được kết tủa F. Nung F ngoài không khí đến khối lượng không đổi thu được chất rắn G, cho khí CO dư qua G nung nóng đến khối lượng không đổi thu được chất rắn H.
Xác định các chất có trong B, C, D, E, F, G, H và viết các phương trình phản ứng xảy ra.
+ Dung dịch B: Al2(SO4)3, CuSO4, Fe2(SO4)3, H2SO4.
Phương trình phản ứng:
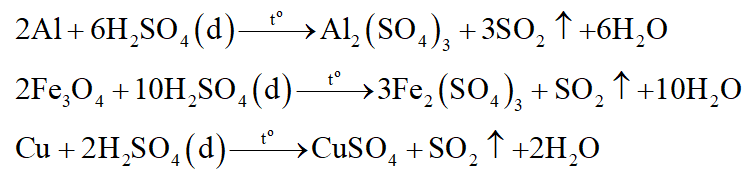
+ Dung dịch C: AlCl3, FeCl2, CuCl2, HCl dư.
+ Chất rắn D: Cu dư; khí E: H2
Phương trình phản ứng:
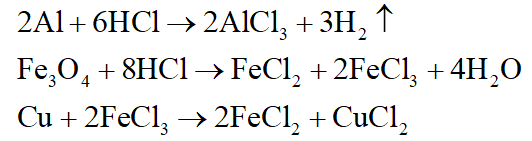
+ Kết tủa F: Cu(OH)2, Fe(OH)2.
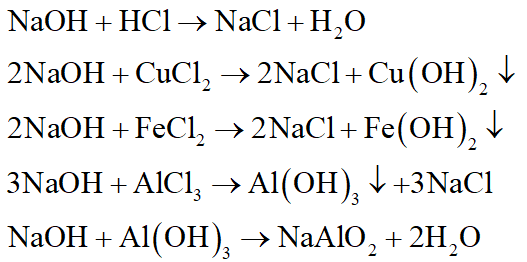
+Chất rắn G: CuO, Fe2O3.
+ Chất rắn H: Cu, Fe.
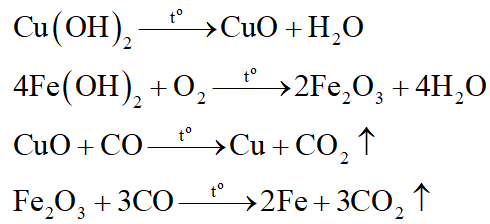
*Nhận xét:
Kim loại tác dụng với H2SO4 đặc nóng:
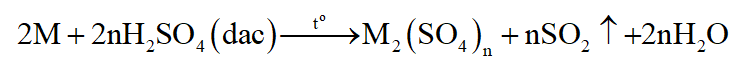
(M là kim loại, trừ Au, Pt; n là hóa trị cao nhất của M)
Hợp chất của kim loại có hóa trị không cao nhất tác dụng với H2SO4 đặc, nóng thu được muối sunfat (hóa trị cao nhất của kim loại) + SO2 + H2O
Thí dụ:
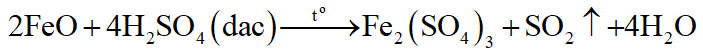
Cu, Ag là kim loại đứng sau hiđro trong dãy hoạt động hóa học nên không tác dụng với dung dịch HCl, H2SO4 loãng.
Fe3O4 được coi là hỗn hợp 2 oxit FeO và Fe2O3 với tỉ lệ mol 1 : 1
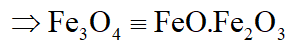
Thí dụ:
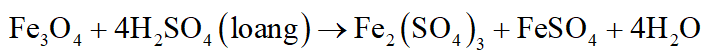
Khi đun nóng, CO khử được oxit của kim loại sau Al trong dãy hoạt động hóa học:
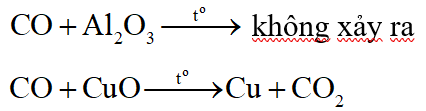
Câu 2:
Cho 5 dung dịch không màu đựng trong 5 bình mất nhãn gồm: NaHSO4, NaCl, Mg(HCO3)2, Na2CO3, Ba(HCO3)2. Không được dùng thêm hóa chất nào khác, hãy nêu phương pháp nhận biết các dung dịch trên.
Lấy ra mỗi hóa chất một ít cho vào 5 ống nghiệm, đánh số thứ tự từ 1 – 5.
- Đun nóng các dung dịch:
+ Dung dịch xuất hiện kết tủa trắng là dung dịch Mg(HCO3)2, Ba(HCO3)2 (nhóm I).
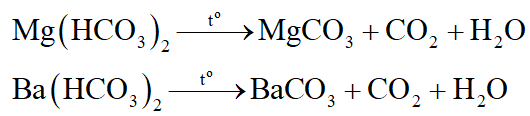
+ Dung dịch không có hiện tượng gì là dung dịch NaHSO4, NaCl, Na2CO3 (nhóm II)
- Lấy lần lượt các dung dịch nhóm (I) nhỏ lần lượt vào các dung dịch nhóm (II).
*Dấu hiệu nhận biết các dung dịch thuộc nhóm I
+ Dung dịch ở nhóm I xuất hiện khí bay lên với 1 dung dịch nhóm II và xuất hiện kết tủa với 1 dung dịch khác của nhóm II là Mg(HCO3)2.
+ Dung dịch ở nhóm I vừa xuất hiện khí bay và vừa có kết tủa với 1 dung dịch nhóm II thì dung dịch nhóm I là Ba(HCO3)2.
*Dấu hiệu nhận biết các dung dịch thuộc nhóm II
+ Dung dịch ở nhóm II xuất hiện khí bay lên với 2 dung dịch nhóm I là dung dịch NaHSO4.
+ Dung dịch ở nhóm II xuất hiện kết tủa với 2 dung dịch nhóm I là dung dịch Na2CO3.
+ Dung dịch còn lại ở nhóm II là NaCl
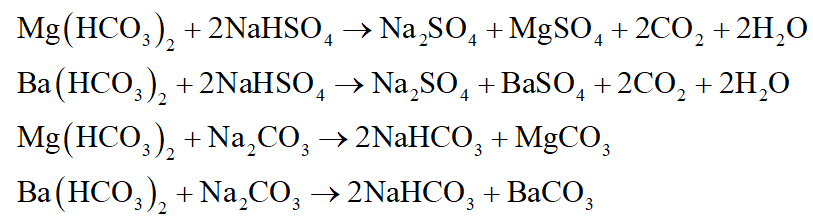
Câu 3:
Viết các phương trình phản ứng thực hiện sơ đồ chuyển hóa sau (ghi rõ điều kiện phản ứng nếu có).

A: (C6H10O5)n; B: C6H12O6; D: C2H5OH; E: CH3COOH; F: CH3COOC2H5; G: CH3COONa
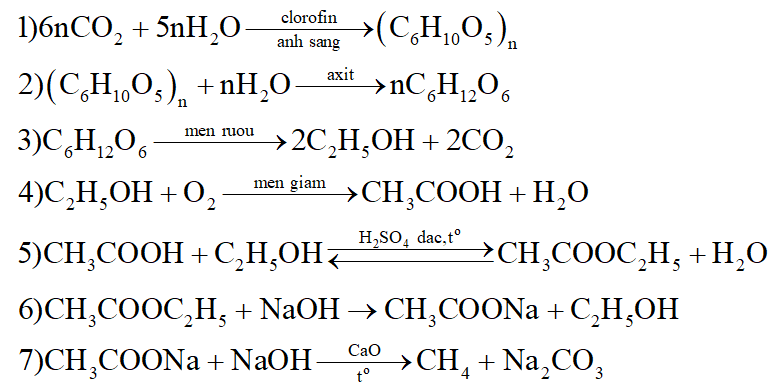
*Nhận xét: Phương trình của phản ứng vôi tôi xút:
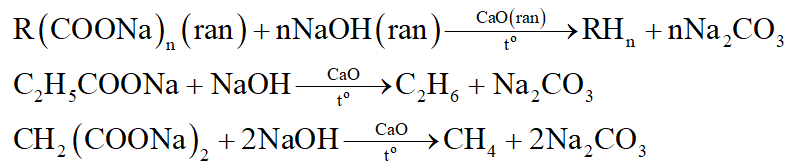
Câu 4:
Từ than đá, đá vôi và các chất vô cơ cần thiết, viết phương trình phản ứng điều chế các chất PVC (Poli (vinylclorua)), PE (Polietilen).
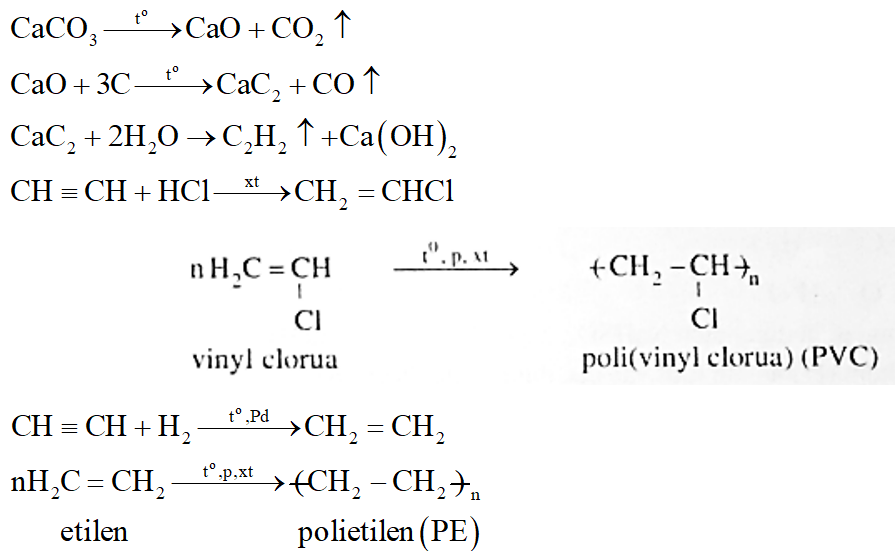
*Nhận xét:
H2 (Ni, to) chuyển được C=C, C C thành C – C.
Thí dụ:
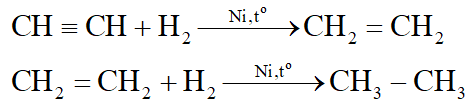
H2 (Pd, PbCO3, to) chỉ chuyển được C C thành C = C
Thí dụ:
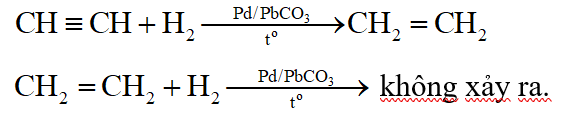
Câu 5:
X, Y là hai chất hữu cơ đơn chức, mạch hở (trong phân tử chỉ chứa C, H, O) có khối lượng mol phân tử bằng 74 g/mol. X tác dụng được với cả Na, NaOH; Y chỉ tác dụng với dung dịch NaOH, không tác dụng với Na. Viết công thức cấu tạo có thể có của X, Y và viết các phương trình phản ứng xảy ra ở trên.
Do X, Y đơn chức tác dụng được với NaOH nên X, Y là axit hoặc este.
X tác dụng được với Na, NaOH nên X là axit.
Y chỉ tác dụng với NaOH, không tác dụng với Na nên Y là este.
Đặt công thức của X, Y là CxHyO2.
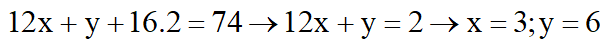
Vậy CTPT: C3H6O2
X: CH3CH2COOH
Y: CH3COOCH3 hoặc HCOOCH2CH3.
Phương trình phản ứng:
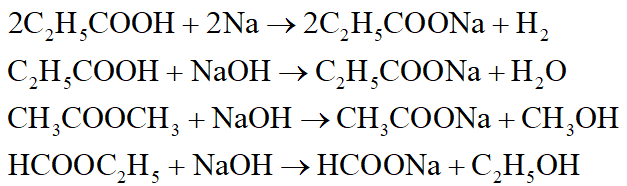
*Nhận xét:
- Tác dụng với Na đặc trưng cho hợp chất có hiđro linh động như ancol, axit,…:
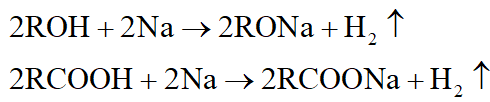
- Tác dụng với dung dịch NaOH đặc trưng cho axit, este:
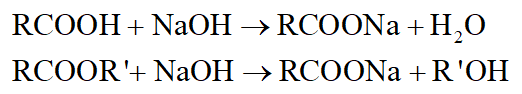
Câu 6:
Cho 122,4 gam hỗn hợp X gồm Cu, Fe3O4 vào dung dịch H2SO4 đặc, nóng, thu được 10,08 lít SO2 (đktc), dung dịch Y và còn lại 4,8 gam kim loại. Cô cạn dung dịch Y thu được m gam muối khan. Tính m.
Các phương trình phản ứng:
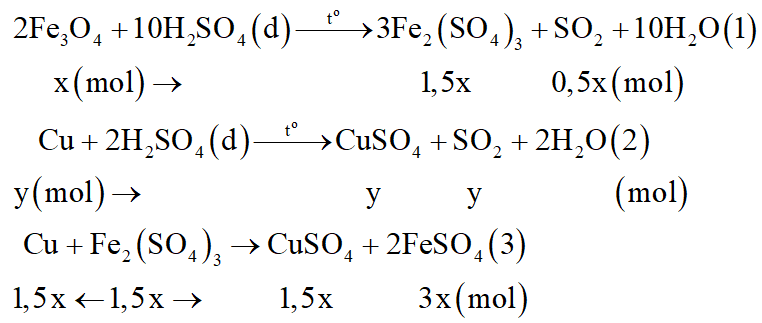
Do sau phản ứng còn 4,8 gam kim loại dư nên dung dịch Y là FeSO4, CuSO4. Kim loại dư là Cu.
Gọi số mol Fe3O4 là x; số mol Cu phản ứng ở (2) là y (x, y > 0)
Theo (1), (3):
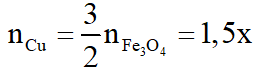
Khối lượng Fe3O4 và Cu phản ứng: 232x + 64 (y + 1,5x) = 122,4 – 4,8
Vậy 328x + 64y = 117,6 (I)
Theo (1), (2):
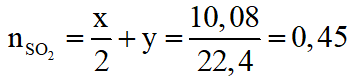
Giải hệ:
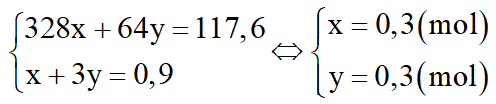
Theo (2), (3):
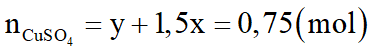
Theo (1), (3):
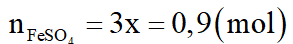
Khối lượng muối m = 0,75.160 + 0,9.152 = 256,8 gam
Câu 7:
Để điều chế 100 lít rượu etylic 46o cần dùng m kg gạo. Biết rằng, trong gạo chứa 80% tinh bột; khối lượng riêng C2H5OH bằng 0,8 g/ml và hiệu suất toàn bộ quá trình điều chế đạt 75%. Tính m.
Các phương trình phản ứng:
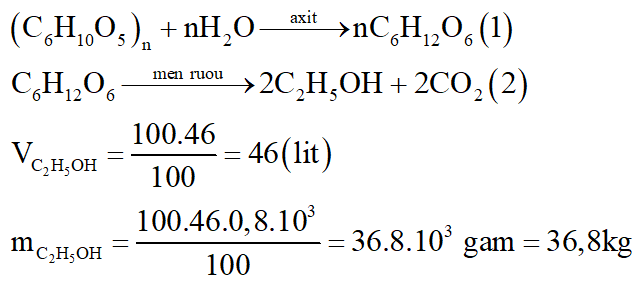
Ta có: (C6H10O5)n tạo ra 2nC2H5OH
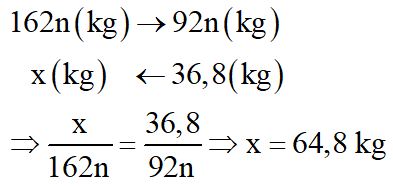
Do H = 75% và trong gạo chứa 80% tinh bột
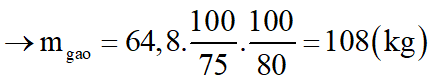
*Nhận xét:
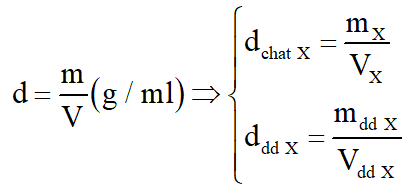
Độ rượu
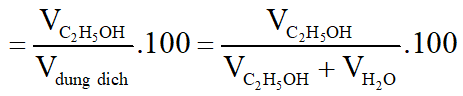
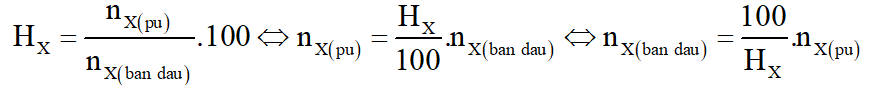
Câu 8:
Cho 16 gam hỗn hợp X gồm bột Mg, Fe vào 600ml dung dịch AgNO3 có nồng độ C (mol/l), khuấy đều hỗn hợp để phản ứng xảy ra hoàn toàn, thu được dung dịch Y và 70,4 gam chất rắn Z. Cho dung dịch NaOH dư vào dung dịch Y thu được kết tủa, nung kết tủa trong không khí ở nhiệt cao đến khối lượng không đổi thu được 16 gam chất rắn T.
Viết các phương trình phản ứng xảy ra, tính khối lượng từng kim loại trong hỗn hợp X và tính giá trị C.
Mg là kim loại mạnh hơn Fe nên suy ra thú tự phản ứng khi cho X tác dụng với dung dịch AgNO3:
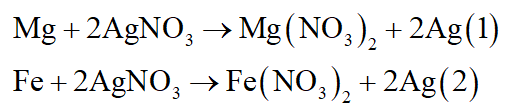
- Do mZ = mX = 16 gam nên khi X tác dụng với AgNO3 thì kim loại dư, AgNO3 hết.
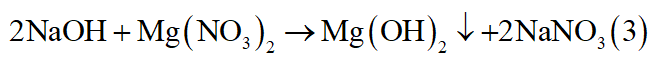
- Có thể có:
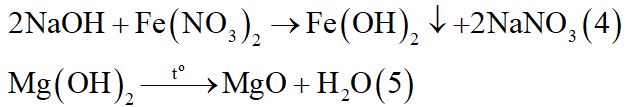
- Có thể có:
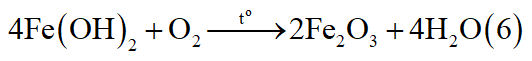
*Trường hợp 1: Mg phản ứng, Fe chưa phản ứng.
nMgO = 0,4 (mol)
Theo phương trình: nMg(phản ứng) = nMgO = 0,4 (mol)
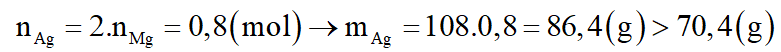
--> (loại)
*Trường hợp 2: Mg phản ứng hết, Fe phản ứng một phần:
Chất rắn Z: Ag, Fe dư.
Dung dịch Y: Mg(NO3)2; Fe(NO3)2.
Đặt số mol Mg là x; số mol Fe ở cả (2) là y; số mol Fe dư là z
Vậy 24x + 56 (y + z) = 16 (I)
Theo phương trình phản ứng (1), (2): nAg = 2x + 2y
Vậy mZ = 108.(2x + 2y) + 56z = 70,4 (II)
Theo phương trình phản ứng:
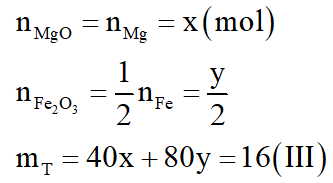
Giải hệ
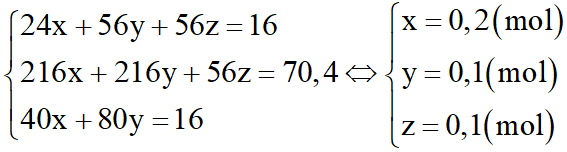
mMg = 0,2.24 = 4,8 gam
mFe = 0,2.56 = 11,2 gam
Theo phương trình phản ứng (1), (2)
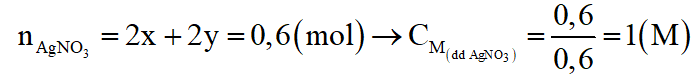
Câu 9:
Tiến hành hai thí nghiệm:
- Thí nghiệm 1: Cho 650ml dung dịch NaOH 2M vào 400ml dung dịch AlCl3 a(M) thì thu được 3b gam kết tủa.
- Thí nghiệm 2: Cho 700ml dung dịch NaOH 2M vào 400ml dung dịch AlCl3 a(M) thì thu được 2b gam kết tủa.
Tìm a, b.
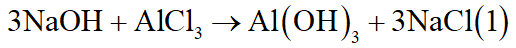
Có thể có:
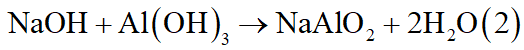
nNaOH(TN1) = 0,65.2 = 1,3(mol)
nNaOH(TN2) = 0,7.2 = 1,4(mol)
nNaOH(TN1) = 1,3(mol) < nNaOH(TN2) = 1,4(mol); lượng AlCl3 là như nhau
mà
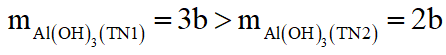
Nên xảy ra 2 trường hợp sau:
*Trường hợp 1:
- Ở thí nghiệm 1, chỉ xảy ra phản ứng (1): NaOH hết, AlCl3 dư.
- Ở thí nghiệm 2 xảy ra 2 phản ứng (1), (2): kết tủa Al(OH)3 tan một phần.
+ Xét TN1:
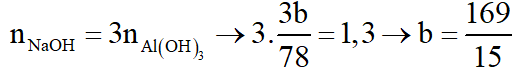
+ Xét TN2:
Theo (1):
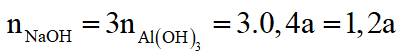
Theo (2):
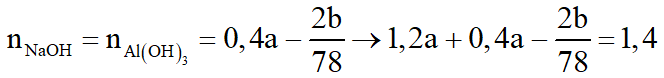
Ta thấy:
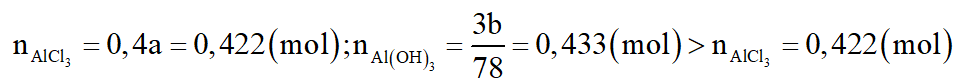
--> loại.
*Trường hợp 2: Cả 2 thí nghiệm kết tủa Al(OH)3 đều tan một phần.
+ Xét TN1:
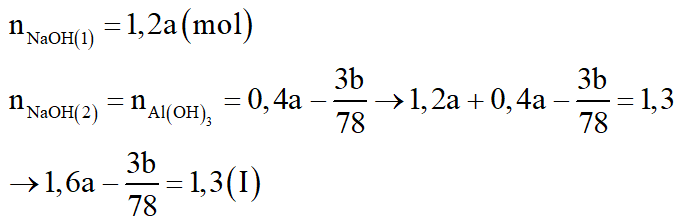
+ Xét TN2:
Theo (1):
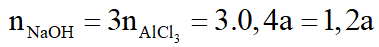
Theo (2):
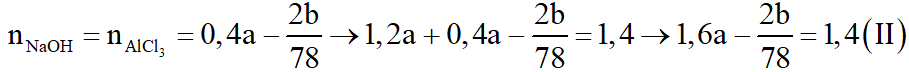
Giải (I), (II) ta được a = 1 (M); b = 7,8 (g).
Câu 10:
Hỗn hợp X gồm 2 este có tỉ lệ số mol trong hỗn hợp là 1:3. Cho a gam hỗn hợp X vào dung dịch NaOH dư, sau phản ứng thu được 4,92 gam muối của một axit hữu cơ đơn chức và 3,18g hỗn hợp 2 rượu no, đơn chức, mạch thẳng (có số nguyên tử C < 5). Nếu đốt cháy hết 3,18g hỗn hợp 2 rượu thu được 3,36 lít CO2 (đktc). Biết các phản ứng xảy ra hoàn toàn.
1. Xác định công thức cấu tạo 2 este, viết các phương trình phản ứng xảy ra.
2. Tính a.
Đặt công thức của 2 este là
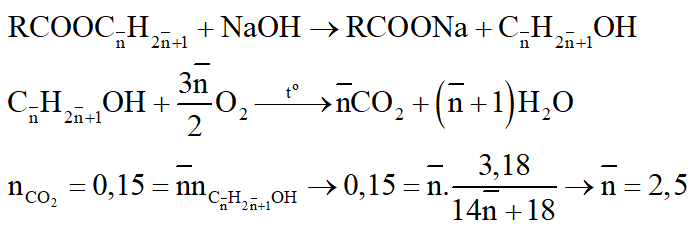
Rượu có số nguyên tử C nhỏ hơn có thể là CH3OH hoặc C2H5OH; rượu có số C lớn hơn đặt là CnH2n+1OH
nrượu = nRCOONa = neste = 0,15:2,5 = 0,06 (mol)
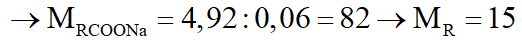
Công thức R là CH3.
*Trường hợp 1:
2 este là CH3COOCH3 (X1) và CH3COOCnH2n+1 (X2)
Do tỉ lệ mol 2 este là 1 : 3.
- Nếu
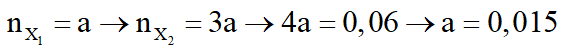
mruọu = 32.0,015 + 0,045.(14n + 18) = 3,18
Suy ra, rượu còn lại có công thức C3H7OH.
Do 2 rượu mạch thẳng nên 2 este là CH3COOCH3 và CH3COOCH2CH2CH3
hoặc CH3COOCH3 và CH3COOCH(CH3)2.
- Nếu
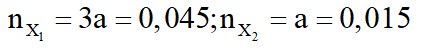
mruọu = 32.0,045 + 0,015.(14n + 18) = 3,18 (loại)
*Trường hợp 2:
2 este là CH3COOC2H5 (X1) và CH3COOCnH2n+1 (X2)
- Nếu
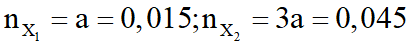
mruọu = 46.0,015 + 0,045.(14n + 18) = 3,18 (loại)
- Nếu
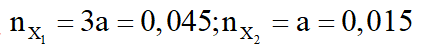
mruọu = 46.0,045 + 0,015.(14n + 18) = 3,18
Vậy rượu còn lại có công thức C4H9OH
Do 2 rượu mạch thẳng nên 2 este là CH3COOCH2CH3 và CH3COOCH2CH2CH2CH3
Hoặc CH3COOCH2CH3 và CH3CHOOCH(CH3)CH2CH3.
Áp dụng định luật bảo toàn khối lượng ta có: meste + mNaOH = mmuối + mrượu
a + 0,06.40 = 4,92 + 3,18
a = 5,7 gam
