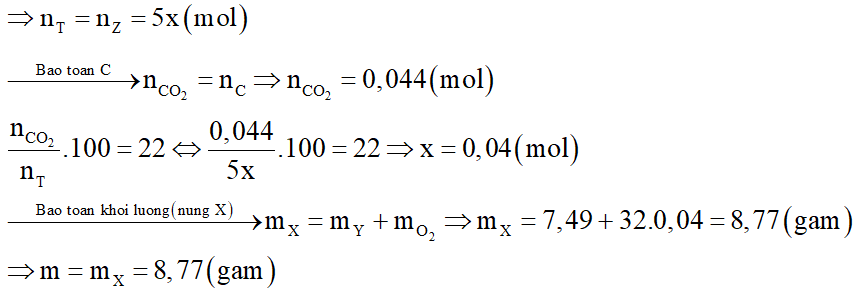- Đề số 1
- Đề số 2
- Đề số 3
- Đề số 4
- Đề số 5
- Đề số 6
- Đề số 7
- Đề số 8
- Đề số 9
- Đề số 10
- Đề số 11
- Đề số 12
- Đề số 13
- Đề số 14
- Đề số 15
- Đề số 16
- Đề số 17
- Đề số 18
- Đề số 19
- Đề số 20
- Đề số 21
- Đề số 22
- Đề số 23
- Đề số 24
- Đề số 25
- Đề số 26
- Đề số 27
- Đề số 28
- Đề số 29
- Đề số 30
- Đề số 31
- Đề số 32
- Đề số 33
- Đề số 34
- Đề số 35
- Đề số 36
- Đề số 37
Trắc nghiệm tổng hợp Hóa 9 Chương 1: Các loại hợp chất vô cơ có đáp án - Đề 22
-
4220 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
R là nguyên tố phi kim. Hợp chất của R với oxi có công thức chung là RH2 chứa 5,88% hiđro về khối lượng. R là nguyên tố nào sau đây?
Đáp án đúng là: D
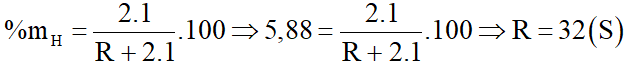
=> R là lưu huỳnh.
Câu 2:
Đốt 3,4 gam khí X người ta thu được 2,24 lít khí SO2 (đktc) và 1,8 gam H2O. Công thức phân tử của khí X là
Đáp án đúng là: C
Số mol các chất là:
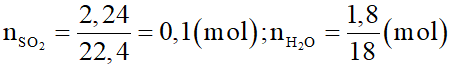
Đốt X thu được SO2 và H2O. Suy ra X chứa S, H và có thể có O.
Sơ đồ phản ứng:
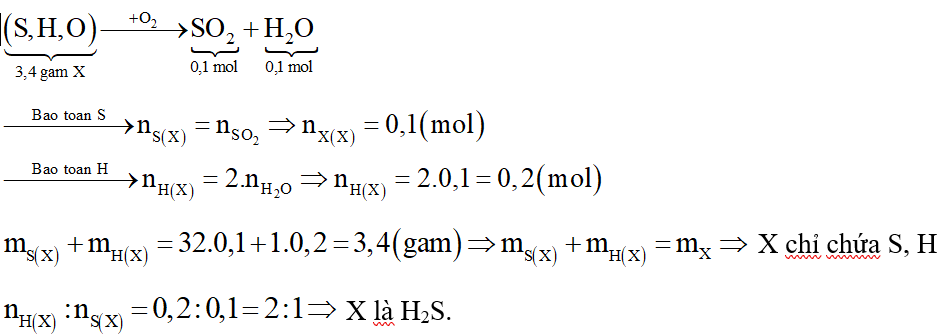
Câu 3:
Hợp chất nào sau đây phản ứng được với clo?
Đáp án đúng là: B
KOH tác dụng với Cl2:
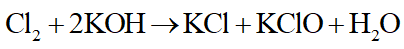
Câu 4:
Cho 12,7 gam muối sắt clorua vào dung dịch NaOH dư có trong bình kín, thu được 9 gam một chất kết tủa. Công thức hóa học của muối là:
Đáp án đúng là: B
Đặt công thức và số mol muối sắt clorua là FeCln: a mol.
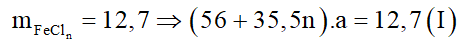
Phương trình hóa học:
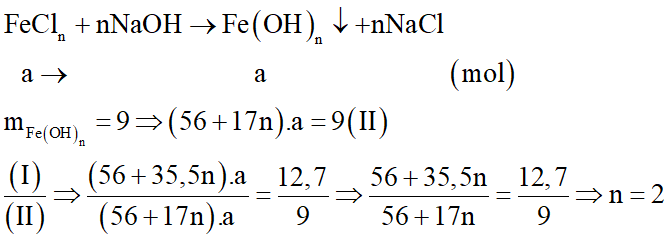
Vạy công thức của muối sắt clorua là FeCl2.
Câu 5:
Nung 150 kg CaCO3 thu được 67,2kg CaO. Hiệu suất của phản ứng là:
Đáp án đúng là: C
Số mol CaO là:
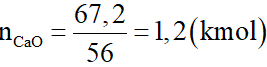
Phương trình hóa học:
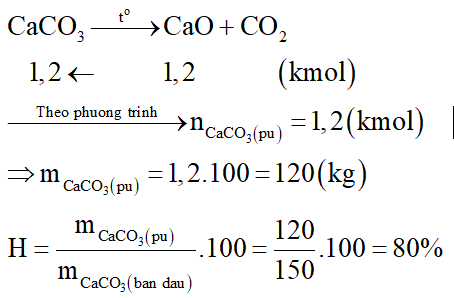
Câu 6:
Dung dịch chất nào sau đây không thể chứa trong bình thủy tinh?
Đáp án đúng là: D
SiO2 (có trong thủy tinh) có phản ứng với dung dịch HF (axit flohiđric).
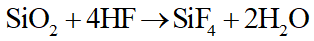
Nên không dùng bình thủy tinh để đựng dung dịch HF.
Nhờ tính chất trên nên HF được dùng để khắc chữ hoặc các họa tiết trên thủy tinh.
Câu 7:
Sục từ từ đến dư khí CO2 vào nước vôi trong. Hiện tượng xảy ra là:
Đáp án đúng là: A
Các phương trình hóa học:
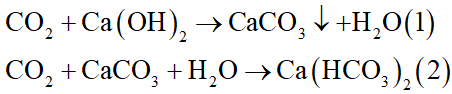
Hiện tượng: Ban đầu nước vôi trong vẩn đục do phản ứng (1), sau đó trong trở lại do phản ứng (2).
Câu 8:
Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần?
Đáp án đúng là: B
|
Chu kì 3: |
Nhóm IA Na Mg Al K |
Trong 1 nhóm theo chiều tăng điện tích hạt nhân, tính kim loại tăng dần nên suy ra: Tính kim loại: Na < K.
Trong 1 chu kì theo chiều tăng điện tích hạt nhân, tính kim loại giảm dần nên suy ra Tính kim loại: Na > Mg > Al.
Tính kim loại giảm dần là: K > Na > Mg > Al.
Câu 9:
Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính phi kim tăng dần?
Đáp án đúng là: C
|
Chu kì 2: |
VA VIA VIIA N O F As |
Trong 1 chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim tăng dần nên suy ra Tính phi kim: N < O < F.
Trong 1 nhóm, theo chiều tăng điện tích hạt nhân, tính phi kim giảm dần nên suy ra tính phi kim: N > P > As.
Tính phi kim tăng dần là: As < P < N < O < F.
Câu 10:
Hấp thụ hoàn toàn 12,8 gam khí SO2 vào 300ml dung dịch NaOH 1,2M thu được dung dịch X. Khối lượng muối trong dung dịch X là:
Đáp án đúng là: D
Số mol các chất là:
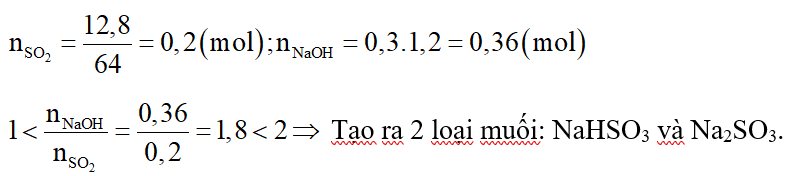
Tạo ra 2 loại muối: NaHSO3 và Na2SO3.
Gọi số mol các muối là NaHSO3: a mol và Na2SO3: b mol.
Các phương trình hóa học:
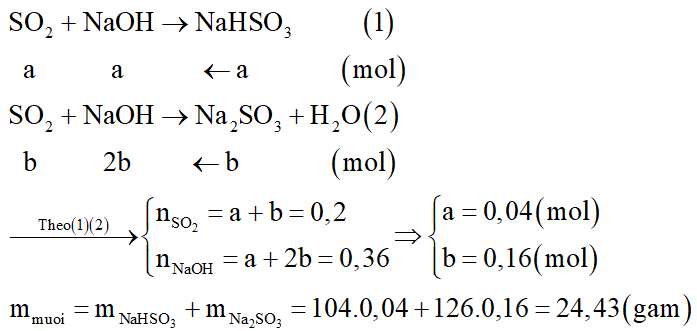
Câu 11:
SiO2 không tác dụng với chất nào sau đây?
Đáp án đúng là: C
Các phương trình hóa học:
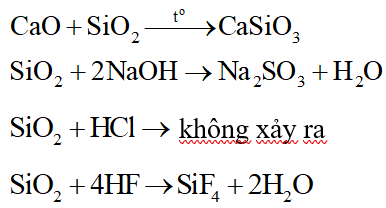
Câu 13:
Phi kim nào sau đây hoạt động mạnh nhất?
Đáp án đúng là: C
Flo (F2) là phi kim hoạt động mạnh nhất.
Câu 14:
Người ta có thể sử dụng nước đá khô (CO2 rắn) để tạo môi trường lạnh và khô trong việc bảo quản thực phẩm và hoa quả vì:
Đáp án đúng là: B
Về cơ bản, các chất khí là truyền nhiệt khá tốt, do đó dựa vào khả năng thăng hoa của nước đá khô người ta dùng nước đá khô để tạo môi trường lạnh.
Câu 15:
Người ta có thể sử dụng nước đá khô (CO2 rắn) để tạo môi trường lạnh và khô trong việc bảo quản thực phẩm và hoa quả vì:
Đáp án đúng là: B
Cu là kim loại yếu hơn Mg, do đó Cu không tác dụng với dung dịch MgSO4.
Các phương trình hóa học xảy ra là:
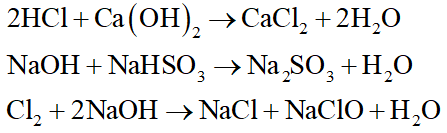
Câu 16:
Trường hợp nào sau đây không xảy ra phản ứng hóa học ở điều kiện thường?
Đáp án đúng là: B
Cu là kim loại yếu hơn Mg, do đó Cu không tác dụng với dung dịch MgSO4.
Các phương trình hóa học xảy ra là:
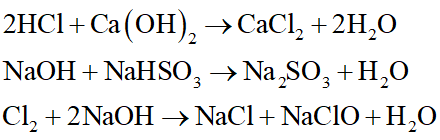
Câu 17:
Để phân biệt các dung dịch: FeCl2, MgCl2, FeCl3, AlCl3 ta có thể dùng dung dịch nào sau đây?
Đáp án đúng là: B
Để phân biệt các dung dịch FeCl2, MgCl2, FeCl3, AlCl3 người ta dùng dung dịch NaOH vì:
|
|
FeCl2 |
MgCl2 |
FeCl3 |
AlCl3 |
|
NaOH |
Kết tủa trắng xanh, chuyển thành nâu đỏ trong không khí |
Kết tủa trắng |
Kết tủa nâu đỏ |
Kết tủa keo trắng, tan trong NaOH dư |
Các phương trình hóa học:
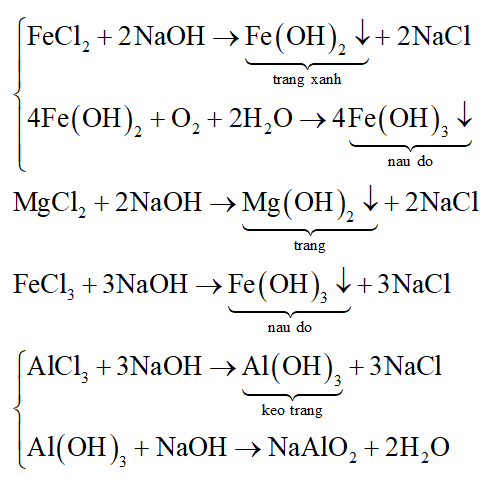
Câu 18:
CO2 không phản ứng với chất nào trong các chất sau?
Đáp án đúng là: C
Các phương trình hóa học:
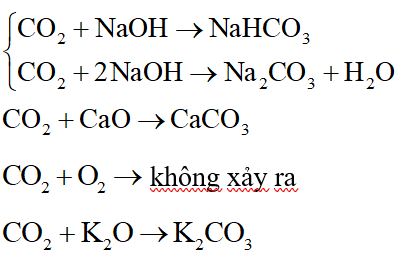
Câu 19:
Cho m gam cacbon tác dụng hết với H2SO4 đặc, nóng thu được V lít ở đktc hỗn hợp khí X gồm CO2 và SO2. Hấp thụ hết X bằng dung dịch NaOH vừa đủ thu được dung dịch Y chỉ chứa hai muối trung hòa. Cô cạn dung dịch Y thu được 35,8 gam muối khan. Giá trị của m và V lần lượt là:
Đáp án đúng là: D
Gọi số mol C là a mol.
Xét giai đoạn C tác dụng với H2SO4 đặc nóng:
Phương trình hóa học:
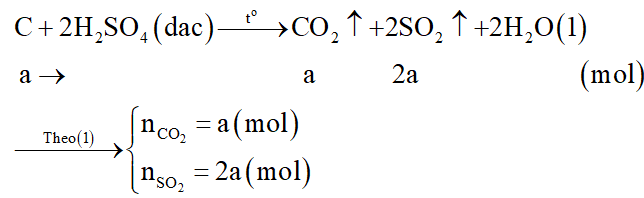
Xét giai đoạn X tác dụng với dung dịch NaOH:
Các phương trình hóa học:
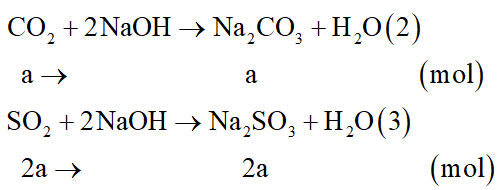
Muối khan thu được là Na2CO3: a mol; Na2SO3: 2a mol.
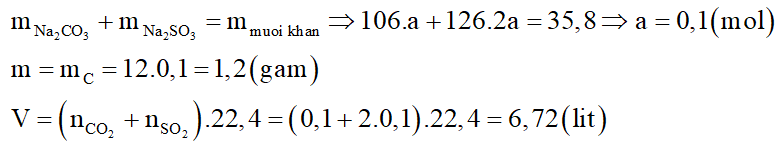
Câu 20:
Kim loại Al không phản ứng với
Đáp án đúng là: D
H2SO4 đặc ở 200C chính là H2SO4 đặc nguội, do đó Al không tác dụng với H2SO4 đặc ở 200C.
Các phản ứng xảy ra là:
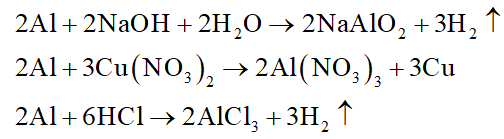
Câu 21:
Phản ứng nào sau đây không tạo ra muối sắt (III)?
Đáp án đúng là: A
Các phương trình hóa học:
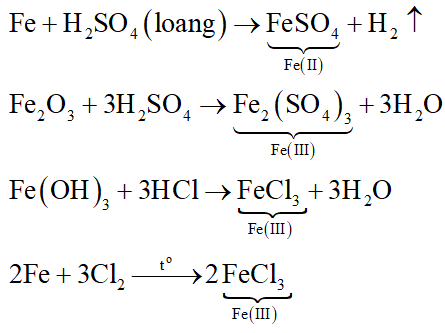
Câu 22:
Ngâm một đinh sắt sạch trong 200ml dung dịch CuSO4 sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch rửa nhẹ làm khô nhận thấy khối lượng đinh sắt tăng thêm 0,8 gam. Nồng độ mol/l của dung dịch CuSO4 đã dùng là:
Đáp án đúng là: D
Gọi số mol Fe phản ứng là a mol
Phương trình hóa học:
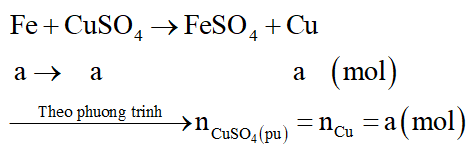
Cu sinh ra sẽ bám vào đinh sắt, do đó khối lượng đinh sắt tăng là:
mđịnh sắt tăng = mCu (sinh ra) – mFe (pứ)
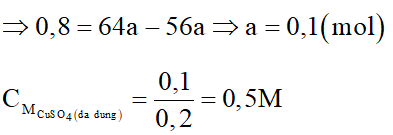
Câu 23:
Để khử hoàn toàn 30 gam hỗn hợp CuO, FeO, Fe2O3, Fe3O4, MgO cần dùng 5,6 lít khí CO (ở đktc). Khối lượng chất rắn sau phản ứng là:
Đáp án đúng là: D
Khi đun nóng, CO khử được oxit của kim loại sau Al trong dãy hoạt động hóa học.
Các phương trình hóa học:
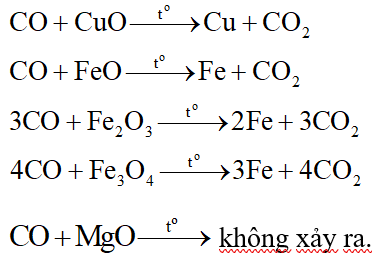
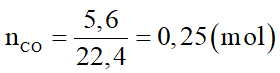
Sơ đồ phản ứng:

Câu 24:
Để làm khô CO2 người ta dẫn khí CO2 có lẫn hơi nước đi qua.
Đáp án đúng là: B
Nguyên tắc làm khô: Chất làm khô phải hấp thụ nước và không phản ứng với chất được làm khô.
Ca(OH)2, NaOH, CaO có tính bazơ, do đó không được dùng để làm khô CO2 (oxit axit) vì:
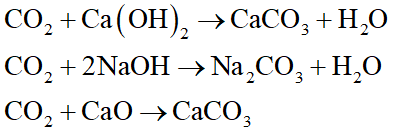
P2O5 (oxit axit) được dùng để làm khô khí CO2 vì:
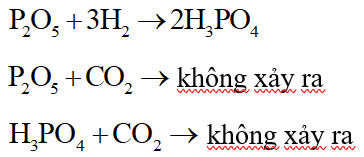
Câu 25:
X là chất được dùng trong công nghiệp dược phẩm (thuốc đau dạ dày…), trong công nghiệp thực phẩm (bột nở…). X là:
Đáp án đúng là: D
Trong công nghiệp người ta thường dùng NaHCO3 để làm thuốc chữa đau dạ dày, bột nở.
Câu 26:
Cho các chất KMnO4, KClO3, MnO2, K2MnO4 lấy cùng số mol tác dụng hoàn toàn với HCl dư, trường hợp nào tạo ít clo nhất?
Đáp án đúng là: B
Lấy 1 mol mỗi chất.
Đối với KMnO4:
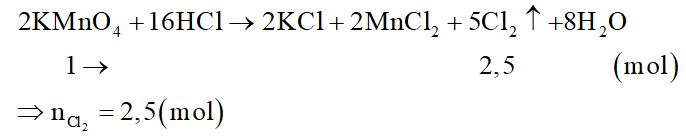
Đối với KClO3:
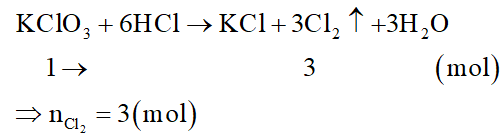
Đối với MnO2:
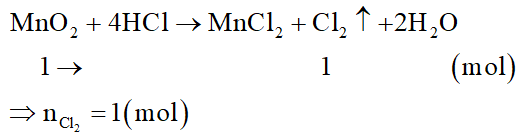
Đối với K2MnO4:
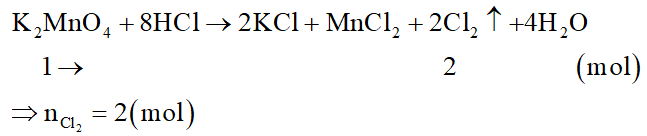
Như vậy MnO2 thu được Cl2 ít nhất.
Câu 27:
Cho thí nghiệm được mô tả như hình vẽ
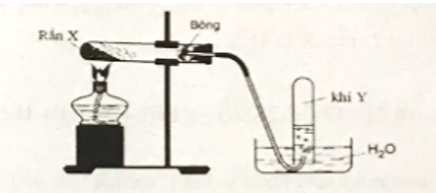
Phát biểu nào sai?
Đáp án đúng là: D
Phương pháp thu khí Y trong thí nghiệm trên là phương pháp đẩy nước, do đó khí Y phải tan rất ít hoặc không tan trong nước mới thu được bằng phương pháp đẩy nước.
Ta đi xét phản ứng nhiệt phân các chất.
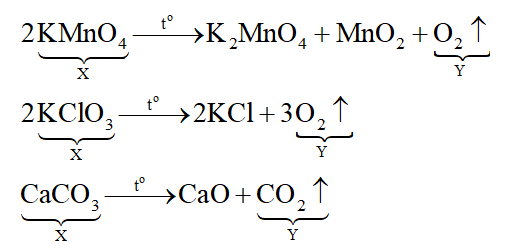
Khí Y có thể là O2 hoặc CO2.
O2 tan rất ít trong nước, do đó có thể thu được bằng phương pháp đẩy nước.
CO2 tan nhiều trong nước (ở điều kiện thường, 1 lít nước hòa tan 1 lít khí CO2), do đó thu CO2 bằng phương pháp đẩy nước là không hợp lý.
Câu 28:
Cho một lượng bột CaCO3 tác dụng hoàn toàn với dung dịch HCl 25,55%. Sau phản ứng thu được dung dịch X trong đó nồng độ HCl còn lại là 17,28%. Thêm vào dung dịch X một lượng bột MgCO3 khuấy đều cho phản ứng xảy ra hoàn toàn thu được dung dịch Y trong đó nồng độ HCl còn lại là 13,56%. Nồng độ phần trăm của MgCl2 trong dung dịch Y gần nhất với
Đáp án đúng là: D
Ta Chú ý rằng các đại lượng liên quan đến tỉ lệ như phần trăm khối lượng, phần trăm thể tích, công thức phân tử, nồng độ phần trăm… thường không phụ thuộc vào lượng chất.
Lấy khối lượng dung dịch HCl ban đầu là 100 gam.
Xét giai đoạn CaCO3 tác dụng với dung dịch HCl:
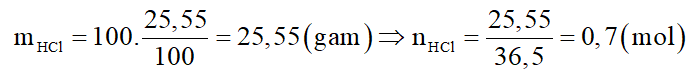
Phương trình phản ứng:
Do dung dịch sau phản ứng hòa tan MgCO3 chứng tỏ HCl dư. Gọi x là số mol CaCO3:

Khối lượng dung dịch X là:
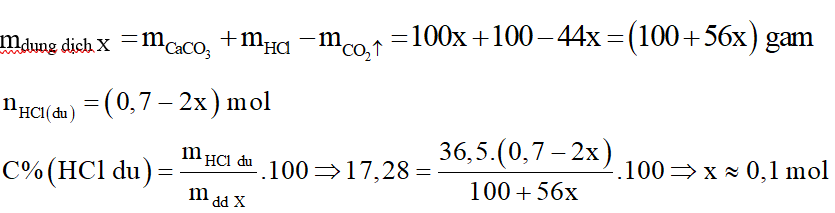
Khi cho dung dịch X tác dụng với MgCO3 thì tương tự như trên HCl dư và MgCO3 hết.
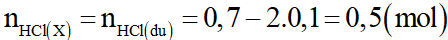
Phương trình phản ứng:
Gọi y là số mol MgCO3.
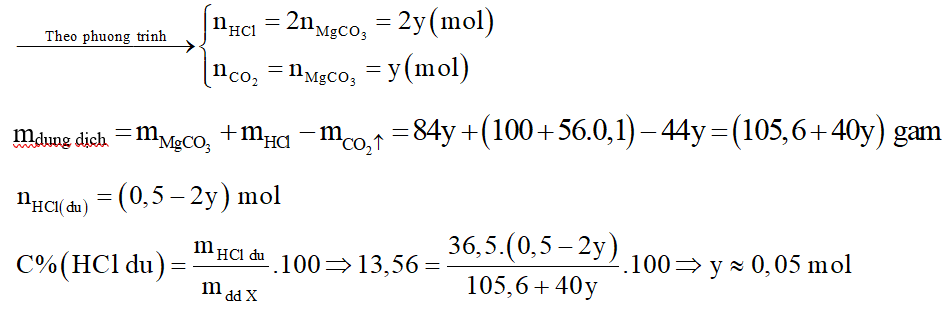
Nồng độ phần trăm MgCl2 trong dung dịch Y là:
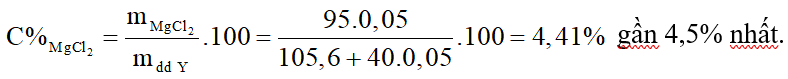
Câu 29:
Hỗn hợp X gồm Na, K, Ba hòa tan hết trong nước dư tạo dung dịch Y và 5,6 lít khí (ở đktc). Để trung hòa dung dịch Y cần V ml dung dịch H2SO4 2M. Giá trị của V là:
Đáp án đúng là: D
Khí thu được là H2
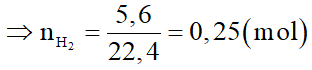
Cả 3 kim loại trong X đều tác dụng với H2O ở điều kiện thường, do đó gọi M là kim loại chung với hóa trị n.
Đặt số mol của M là a mol.
Phương trình hóa học:
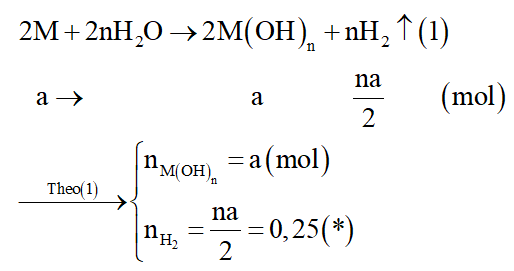
Dung dịch X là dung dịch M(OH)n. Phản ứng trung hòa dung dịch X:
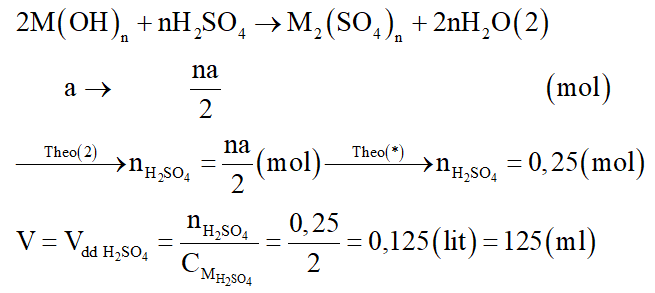
Câu 30:
Nung m gam hỗn hợp X gồm KClO3 và KMnO4 thu được chất rắn Y (KCl, K2MnO4, MnO2, KMnO4) và O2. Trong Y có 1,49 gam KCl chiếm 19,893% theo khối lượng. Trộng lượng O2 ở trên với không khí theo tỉ lệ thể tích thu được hỗn hợp khí Z. Đốt cháy hết 0,528 gam cacbon bằng hỗn hợp Z thu được hỗn hợp khí T gồm 3 khí O2, N2, CO2, trong đó CO2 chiếm 22% về thể tích. Biết trong không khí có 80% N2 và 20% O2 theo thể tích. Giá trị của m là:
Đáp án đúng là: B
Khối lượng của Y là
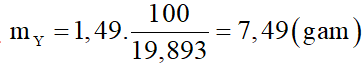
Xét giai đoạn C tác dụng với Z.
Số mol C là:
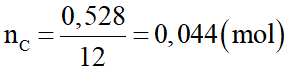
Gọi số mol O2 là x mol
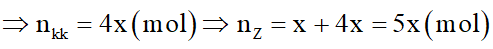
Do O2 dư, tức là cacbon cháy hết theo phương trình:
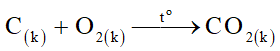
Từ phương trình ta nhận thấy số mol khí trước và sau không thay đổi