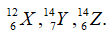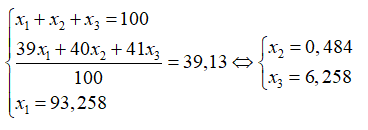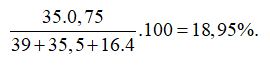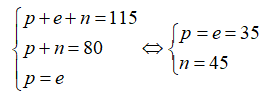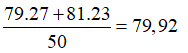Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 1 - Đề 1)
-
4136 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 3:
Nguyên tử O (Z = 8) nhận thêm 2e thì cấu hình e tương ứng của nó là
Chọn B
Cấu hình electron của Oxi: .
Sau khi O nhận thêm 2e được ion có cấu hình electron là: .
Câu 4:
Cho cấu hình electron của Al (Z = 13): . Hỏi Al thuộc loại nguyên tố gì?
Chọn D
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp p.
Câu 5:
Trong tự nhiên Kali có ba đồng vị: ( = 93,258%); ( %); (%). Biết nguyên tử khối trung bình của kali là 39,13. Giá trị của và lần lượt là
Chọn A
Theo bài ra ta có hệ phương trình:
Câu 6:
Ở trạng thái cơ bản S (Z = 16) có bao nhiêu electron ở phân lớp ngoài cùng?
Chọn D
Cấu hình electron của S là: [Ne] → Số electron ở phân lớp ngoài cùng là 4.
Câu 7:
Trong tự nhiên, Clo có 2 đồng vị và , trong đó đồng vị chiếm 75% về số đồng vị. Phần trăm khối lượng của trong là (cho nguyên tử khối: K=39, O=16)
ChọnC
Nguyên tử khối trung bình của Cl là :
Giả sử có 1 mol → Số mol Cl = 1; số mol là 0,75.
Phần trăm khối lượng của trong là
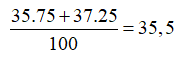
Câu 10:
Nguyên tử của nguyên tố nào sau đây có số hạt nơtron nhỏ nhất ?
Chọn A
Số nơtron của F là 19 – 9 = 10.
Số nơtron của Ca, K và Sc đều là 20.
Câu 11:
Ở trạng thái cơ bản,cấu hình electron nguyên tử nitơ (Z = 7) có bao nhiêu phân lớp?
Chọn A
Cấu hình electron của N là: . Vậy cấu hình electron nguyên tử N gồm 3 phân lớp.
Câu 14:
Nguyên tử Ca (Z = 20) có số e ở lớp ngoài cùng là
Chọn B
Cấu hình electron nguyên tử Ca là: . Vậy số e lớp ngoài cùng là 2.
Câu 15:
Nguyên tử X có tổng số hạt proton, nơtron và electron là 115. Ngoài ra số khối của X là 80. Số lớp electron và số electron lớp ngoài của X cùng lần lượt là
Chọn B
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có hệ phương trình:
Cấu hình electron nguyên tử X là: . Vậy X có 4 lớp electron và 7electron lớp ngoài cùng.
Câu 17:
Cho nguyên tử nguyên tố X có 12 proton và 12 nơtron. Kí hiệu nguyên tử đúng của X là?
Chọn B
Số khối A = 12 + 12 = 24.
Số hiệu nguyên tử Z = số proton = 12.
Kí hiệu nguyên tử là
Câu 19:
Cho cấu hình electron của Fe (Z = 26): . Hỏi Fe thuộc loại nguyên tố gì?
Chọn B
Theo trật tự phân mức năng lượng, electron cuối cùng điến vào phân lớp d.
Câu 20:
Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố R là
Chọn D
Cấu hình electron của R là
Vậy số hiệu nguyên tử của R = số electron của R = 15.
Câu 21:
Một nguyên tố X có 2 đồng vị có tỉ lệ số nguyên tử là 27/23. Hạt nhân của X có 35 proton. Đồng vị thứ nhất có 44 nơtron. Đồng vị thứ hai có nhiều hơn đồng vị thứ nhất là 2 nơtron. Nguyên tử khối trung bình của nguyên tố X là
Chọn C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là:
Câu 22:
Trong tự nhiên, nguyên tố đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là
Chọn A
Câu 23:
Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là
Chọn D
Câu 24:
Cấu hình electron nào sau đây là của kim loại
Chọn D
Nguyên tử có 1,2, 3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại.
Ta có cấu hình e: → 2 e lớp ngoài cùng.
Câu 25:
Có 3 nguyên tử: . Những nguyên tử nào là đồng vị của một nguyên tố?
Chọn C
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron.
X và Z cùng số proton.
Câu 27:
Ion có 18 electron và 16 proton mang điện tích là
Chọn B
Ion có số electron > số proton → mang điện tích âm.
Số đơn vị điện tích âm là 18 – 16 = 2.
Vậy ion mang điện tích .
Câu 28:
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
Chọn D
Câu 29:
Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
Chọn B
Sự khác nhau về số nơtron tạo ra các đồng vị của cùng một nguyên tố.
Câu 30:
Trên vỏ nguyên tử, các electron chuyển động xung quanh hạt nhân................ Hãy chọn cụm từ thích hợp đối với chỗ trống ở trên.
Chọn B.
Các electron chuyển động xung quanh hạt nhân với vận tốc lớn và không theo quỹ đạo xác định.