Đề thi Học kì 1 Hóa 10 có đáp án
-
1418 lượt thi
-
30 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Trong tự nhiên, kali có 3 đồng vị : Biết nguyên tử khối trung bình của kali là 39,13. Giá trị của lần lượt là
Chọn C
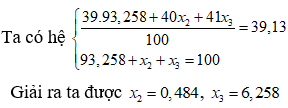
Câu 2:
Có 3 nguyên tử : . Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
Chọn D
X và Z có cùng số proton = 6 nên là đồng vị của cùng một nguyên tố hóa học.
Câu 3:
Nguyên tử Na (Z = 11) bị mất đi một electron thì cấu hình electron của ion tạo thành là
Chọn C
Cấu hình electron của Na là: 1s22s22p63s1
Khi mất đi 1 electron thì cấu hình electron của ion tạo thành là: 1s22s22p6.
Câu 4:
Cho cấu hình electron nguyên tử của Fe (Z = 26) : . Fe thuộc loại nguyên tố
Chọn B
Trật tự phân mức năng lượng: 1s 2s 2p 3s 3p 4s 3d …
→ Fe thuộc loại nguyên tố d.
Câu 5:
Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z =13). Nguyên tố mà nguyên tử của nó có số electron độc thân lớn nhất ở trạng thái cơ bản là
Chọn C
Cấu hình electron nguyên tử:
Cr (z = 24): [Ar]3d54s1 → 6 electron độc thân.
Fe (Z = 26): [Ar]3d64s2 → 4 electron độc thân.
P (z = 15): [Ne] 3s23p3 → 3 electron độc thân.
Al (z = 13): [Ne]3s23p1 → 1 electron độc thân.
Câu 6:
Nguyên tử X có tổng số hạt proton, nơtron, electron là 115 và số khối là 80. Số lớp electron và số electron ở lớp ngoài cùng của X lần lượt là
Chọn A
Số electron trong nguyên tử X là 115 – 80 = 35
Cấu hình electron trong nguyên tử của X là ![]() . Vậy X có 4 lớp electron và 7 electron lớp ngoài cùng.
. Vậy X có 4 lớp electron và 7 electron lớp ngoài cùng.
Câu 7:
Nguyên tử nguyên tố X có 12 proton và 12 nơtron. Kí hiệu nguyên tử của X là
Chọn A
Số hiệu nguyên tử (Z) = số proton = 12.
Số khối (A) = số proton + số nơtron = 12 + 12 = 24.
→ Kí hiệu nguyên tử:
Câu 8:
Nguyên tử khối trung bình của đồng kim loại là 63,546. Đồng tồn tại trong tự nhiên với hai đồng vị là và . Thành phần phần trăm của đồng theo số nguyên tử là
Chọn A
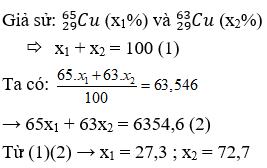
Câu 9:
Nguyên tử khối trung bình của clo là 35,5. Clo trong tự nhiên có hai đồng vị là và Thành phần phần trăm về khối lượng của chứa trong (với hiđro là đồng vị , oxi là đồng vị ) là
Chọn D
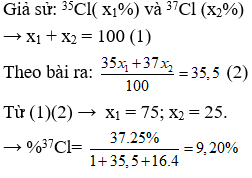
Câu 10:
Cho các nguyên tố M (Z = 11), R (Z = 19) và X (Z = 3). Khả năng tạo ion từ nguyên tử của các nguyên tố trên tăng dần theo thứ tự nào sau đây?
Chọn C
Ta có M, R, X thuộc cùng nhóm IA, Zx < ZM <ZR → Tính kim loại X < M < R.
Khả năng tạo ra ion từ nguyên tử của X < M < R.
Câu 11:
Hợp chất với hiđro của nguyên tố X có công thức hóa học . Biết thành phần phần trăm về khối lượng của oxi trong oxit ứng với hóa trị cao nhất của X là 74,07%. Tên gọi của X là
Chọn A
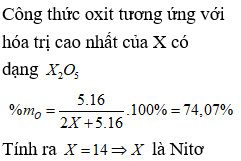
Câu 13:
Nguyên tố R có công thức oxit ứng với hóa trị cao nhất là . Công thức hợp chất khí của R với hiđro là
Chọn B
Hóa trị của R trong oxit cao nhất là V → Hóa trị của R trong hợp chất khí với H là III
→ Công thức hợp chất khí của R với H là RH3.
Câu 14:
Trong bảng tuần hoàn, nguyên tố nào dưới đây có độ âm điện lớn nhất?
Chọn B
F có độ âm điện lớn nhất (3,98).
Câu 15. B
Z và T thuộc cùng nhóm VIA; Z ở chu kỳ 3; T ở chu kỳ 2 → Tính phi kim: T > Z.
X và Y thuộc cùng nhóm IA; X ở chu kỳ 4; Y ở chu kỳ 3 → Tính phi kim: Y > X
Y và Z thuộc cùng chu kỳ 3; Zy < Zz → Tính phi kim: Y < Z.
Thứ tự tăng dần tính phi kim: X < Y < Z < T.
Câu 15:
Các nguyên tố X, Y, Z, T có cấu hình electron nguyên tử lần lượt là:
Thứ tự tăng dần tính phi kim của các nguyên tố trên là
Chọn B
Z và T thuộc cùng nhóm VIA; Z ở chu kỳ 3; T ở chu kỳ 2 → Tính phi kim: T > Z.
X và Y thuộc cùng nhóm IA; X ở chu kỳ 4; Y ở chu kỳ 3 → Tính phi kim: Y > X
Y và Z thuộc cùng chu kỳ 3; Zy < Zz → Tính phi kim: Y < Z.
Thứ tự tăng dần tính phi kim: X < Y < Z < T.
Câu 16:
Cấu hình electron nguyên tử của các nguyên tố X, Y, Z, T như sau:
Số electron hóa trị trong nguyên tử của các nguyên tố X, Y, Z, T lần lượt là
Chọn D
Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa.
→ X có 2e hóa trị; Y có 7e hóa trị; Z có 7e hóa trị; T có 2e hóa trị.
Câu 17:
Ion có cấu hình electron nguyên tử là . Nguyên tố M thuộc nhóm
Chọn A
Ta có: M → M3+ + 3e
→ Cấu hình electron của M là: [Ar]3d64s2
Vậy M thuộc nhóm VIIIB (do 8 electron hóa trị, nguyên tố d).
Câu 18:
Cấu hình electron nguyên tử của là .
Kết luận nào sau đây sai?
Chọn D
D sai vì nguyên tử K có 1 electron ở lớp ngoài cùng.
Câu 19:
Nguyên tử Al có 3 electron hóa trị. Kiểu liên kết hóa học được hình thành khi Al liên kết với 3 nguyên tử flo là
Chọn D
Hiệu độ âm điện của F với Al là 3,98 – 1,16 = 2,37 > 1,7.
Vậy liên kết hóa học hình thành khi Al liên kết với 3 nguyên tử flo là liên kết ion.
Câu 20:
Dãy nào sau đây không chứa hợp chất ion?
Chọn B
CO2; Cl2; CCl4 là các hợp chất cộng hóa trị.
Câu 21:
Cho các hợp chất:
Trong các chất trên, những chất có liên kết ion là
Chọn D
NH3; H2O; CH4 là những hợp chất cộng hóa trị.
K2S; MgCl2; Na2O là những hợp chất ion.
Câu 22:
Số oxi hóa của Cu (trong Cu), K (trong ), Mn (trong KMnO4), N (trong ) lần lượt là
Chọn A
Số oxi hóa của Cu trong đơn chất là 0 → loại B và D
Số oxi hóa của K trong K+ là + 1.
Gọi số oxi hóa của Mn là x, ta có: (+1) + x + (-2).4 = 0 → x = +7 → loại C.
Câu 23:
Cho 3 ion: . Phát biểu nào sau đây sai?
Chọn D
Số proton của Na+, Mg2+, F¯ lần lượt là 11, 12 và 9.
Câu 24:
Ion nào sau đây có 32 electron?
Chọn A
Số electron của là: 6 + 8.3 + 2 = 32.
Số electron của là: 16 + 8.4 + 2 = 50.
Số electron của NH4+ là: 7 + 1.4 – 1 = 10.
Số electron của NO2¯ là: 7 + 8.2 + 1 = 24.
Câu 25:
Trong các phản ứng sau, phản ứng nào không đóng vai trò là chất khử?
Chọn D
2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
Số oxi hóa của N không thay đổi sau phản ứng → NH3 không đóng vai trò là chất khử.
Câu 26:
Cho phương trình phản ứng:
Tỉ lệ a : b là
Chọn D
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Vậy a : b = 1 : 4.
Câu 27:
Cho phản ứng hóa học:
Sau khi cân bằng phương trình hóa học của phản ứng với hệ số tối giản, tổng hệ số của các chất tham gia phản ứng là
Chọn B
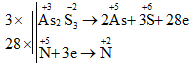
3As2S3 + 28HNO3 + 4H2O →6H3AsO4 + 9H2SO4 + 28NO
→ Tổng hệ số các chất tham gia phản ứng là: 3 + 28 + 4 = 35.
Câu 28:
Hai nguyên tố X và Y thuộc cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA .
Phát biểu nào sau đây đúng?
Chọn B
![]()
X và Y thuộc cùng một chu kì và hai nhóm liên tiếp (nhóm IIA và IIIA) nên ta có các trường hợp sau


Ở nhiệt độ thường X khử được nước, không khử được ion trong dung dịch (do sẽ phản ứng với nước trước), hợp chất với oxi có dạng CaO, trong X có 20 proton.
Câu 29:
Trong phân tử có tổng số hạt (proton, nơtron, electron) là 140 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 44 hạt. Số khối của ion lớn hơn số khối của ion là 23. Tổng số hạt proton, nơtron, electron trong ion nhiều hơn trong ion là 31 hạt. Nhận xét nào sau đây không đúng?
Chọn C
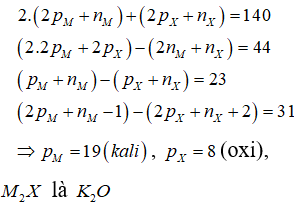
Câu 30:
Đốt cháy hoàn toàn 7,2 gam kim loại M (có hóa trị hai không đổi trong hợp chất) trong hỗn hợp khí . Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Kim loại M là
Chọn A
Cách 1:
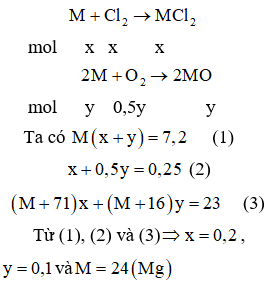
Cách 2:
Gọi số mol của Cl2 và O2 phản ứng lần lượt là x và y mol
→ nkhí = 0,25 mol → x + y = 0,25 (1)
Bảo toàn khối lượng có mkhí= 23 – 7,2= 15,8 gam
→ 71x + 32y = 15,8 (2)
Từ (1) và (2) → x = 0,2 và y = 0,05
Bảo toàn electron có:
2.nM = 2.nCl2 + 4.nO2 → nM= 0,3 → MM = 7,2 : 0,3 = 24 (g/mol)
Vậy kim loại M là Mg.
