Bài tập trắc nghiệm Ôn tập học kì 1 cực hay có đáp án
-
889 lượt thi
-
15 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Trong ion có 42 electron. Công thức hóa học của là
Chọn D
Số proton trong ion XO3¯ là 42 – 1 = 41.
→ Zx + 8.3 = 41 → Zx = 17. Vậy X là Clo.
Câu 2:
Hợp chất ion A tạo từ ion . Tổng số hạt trong phân tử A là 60. Số hạt mang điện nhiều hơn số hạt không mang điện là 20 hạt. Số hạt mang điện của ion ít hơn của ion là 4 hạt. Số hạt mang điện trong ion là
Chọn C

Câu 3:
Các ion và nguyên tử Z đều có cấu hình electron là .
và Z lần lượt là
Chọn B
Z là khí hiếm Ne → Loại A và D.
Li+ có cấu hình electron là [He] → loại C.
Câu 4:
Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là . Trong oxit mà R có hóa trị cao nhất, oxi chiếm 74,07% về khối lượng. Nguyên tố R là
Chọn A
Công thức oxit ứng với hóa trị cao nhất của R là
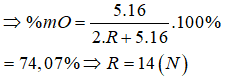
Câu 5:
Cation có tổng số hạt cơ bản (proton, nơtron, electron) bằng 80, trong đó tỉ lệ số hạt electron so với số hạt nơtron là 4/5. Vị trí của X trong bảng tuần hoàn là
Chọn C
Cation có số hạt proton là X, số hạt nơtron là N và số electron là (Z-2)
Ta có 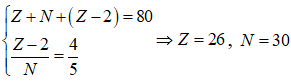
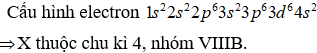
Câu 6:
Tổng số hạt proton của 3 nguyên tử X, Y, Z là 45. X và Y thuộc cùng một nhóm và ở 2 chu kì liên tiếp. X và Z kế tiếp nhau trong cùng một chu kì. Các hiđroxit tương ứng với X, Y, Z là . Thứ tự giảm dần tính bazơ của là
Chọn C
X và Z kế tiếp nhau trong 1 chu kỳ, giả sử Zx < Zz → Zz = Zx + 1.
Tổng số proton của X, Y và Z là 45 → Zx + ZY + Zx + 1 = 45 → 2Zx + ZY = 44 (1).
X và Y thuộc cùng một nhóm và ở hai chu kỳ liên tiếp, giả sử Zx < Zy.
Trường hợp 1: Zy – Zx = 8; kết hợp với (1) giải hệ phương trình được:
Zx = 12; Zy = 20 → Zz = 13.
→ Tính kim loại Y > X > Z → Tính bazơ: H2 > H1 > H3 →chọn C.
Trường hợp 2: ZY – Zx = 18; kết hợp với (1) giải hệ phương trình được:
Zx = 8,67 và Zy = 26,67 (loại).
Chú ý: Với bài tự luận để chặt chẽ thì xét tiếp các trường hợp Zx > ZY; Zx > ZZ ….
Câu 7:
X, Y, Z là những nguyên tố có số hiệu nguyên tử là 8, 19, 16. Nếu các cặp X và Y, Y và Z, X và Z tạo thành liên kết thì các cặp nào sau đây có thể là liên kết cộng hóa trị có cực?
Chọn A
Cấu hình electron nguyên tử X là: [He]2s22p4 → X là phi kim, thuộc nhóm VIA
Cấu hình electron nguyên tử Y là: [Ar]4s1 → Y là kim loại, thuộc nhóm IA.
Cấu hình electron nguyên tử Z là: [Ne]3s23p4 → Z là phi kim, thuộc nhóm VIA.
→ Liên kết hình thành giữa X và Y; Y và Z là liên kết ion.
Liên kết hình thành giữa X và Z là liên kết cộng hóa trị có cực.
Câu 8:
Dãy chất nào trong các dãy sau đây đều gồm các chất mà phân tử có liên kết ion?
Chọn D
A loại vì HNO3 là hợp chất cộng hóa trị.
B loại vì HCl là hợp chất cộng hóa trị.
C loại vì H2S, SO2 là hợp chất cộng hóa trị.
Câu 9:
Dãy chất nào trong các dãy sau đây đều gồm các chất mà phân tử chỉ có liên kết cộng hóa trị phân cực?
Chọn B
A sai vì KCl là hợp chất ion.
C sai vì liên kết trong phân tử N2 là liên kết cộng hóa trị không phân cực.
D sai vì liên kết trong phân tử CH4 và C2H2 là liên kết cộng hóa trị không phân cực.
Câu 10:
Cân bằng phương trình hóa học của phản ứng sau (với hệ số các chất là số nguyên tối giản) :
Các hệ số của lần lượt là
Chọn A
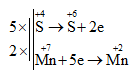
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + 2H2SO4 + K2SO4
→ Các hệ số của KMnO4 và H2SO4 lần lượt là 2 và 2
Câu 12:
Cho 11,36 gam hỗn hợp Fe, FeO, phản ứng hết với dung dịch HNO3 dư thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối. Giá trị của m là
Chọn A
Cách 1:
Giả thiết hỗn hợp ban đầu được tạo ra từ a mol Fe và b mol
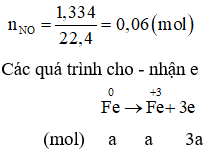
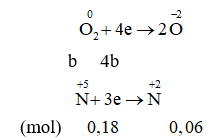
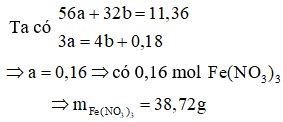
Cách 2:
Quy đổi hỗn hợp về Fe (x mol) và O (y mol)
→ 56x + 16y = 11,36 mol (1)
Bảo toàn e: 3nFe = 2nO + 3 nNO
→ 3x – 2y = 0,18 (2)
Từ (1)(2) → x = 0,16; y = 0,15
Số mol NO3- = ne cho = 3 nFe = 0,48 mol
mmuối = mFe + mNO3- = 0,16.56 + 0,48.62 = 38,72g
Câu 13:
Cho 500 ml dung dịch hỗn hợp gồm 0,2M và HCl 1M. Khi cho Cu tác dụng với dung dịch thì chỉ thu được một sản phẩm duy nhất là NO. Khối lượng Cu có thể hoà tan tối đa vào dung dịch là :
Chọn D
nHNO3 = 0,1 mol; nHCl = 0,5 mol
3Cu + 2HNO3 +6HCl → 3CuCl2 + 2NO +4H2O
→ HNO3 hết; nCu = 1,5. nHNO3 = 0,15 mol → mCu = 9,6g.
Câu 14:
Hợp chất Z tạo bởi 2 nguyên tố M, R có công thức trong đó R chiếm 6,667% khối lượng. Trong hạt nhân nguyên tử M có số nơtron nhiều hơn số proton 4 hạt; còn trong hạt nhân R có số nơtron bằng số proton; tổng số hạt proton trong Z là 84 và . Khối lượng phân tử Z là:
Chọn C
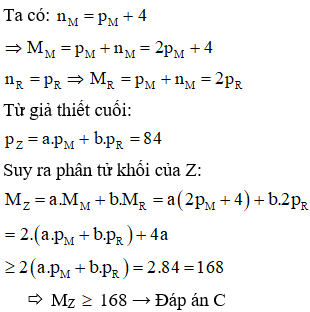
Câu 15:
Hợp chất H có công thức trong đó M chiếm về khối lượng, X là phi kim ở chu kỳ 3, trong hạt nhân của M có số proton ít hơn số nơtron là 4; trong hạt nhân của X có số proton bằng số nơtron. Tổng số proton trong 1 phân tử H là 58. Cấu hình electron ngoài cùng của M là
Chọn C
Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số nơtron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số nơtron bằng số proton → ZX = NX
MH =ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX = 58 + NM + 58 - ZM = 116 + NM - ZM