Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 1)
-
1418 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 3:
Nguyên tử O (Z = 8) nhận thêm 2e thì cấu hình e tương ứng của nó là
Đáp án B
Cấu hình electron của Oxi: .
Sau khi O nhận thêm 2e được ion có cấu hình electron là: .
Câu 4:
Cho cấu hình electron của Al (Z = 13): 1s22s22p63s23p1. Hỏi Al thuộc loại nguyên tố gì?
Đáp án D
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp p.
Câu 5:
Ở trạng thái cơ bản S (Z = 16) có bao nhiêu electron ở phân lớp ngoài cùng?
Đáp án D
Cấu hình electron của S là: → Số electron ở phân lớp ngoài cùng là 4.
Câu 7:
Nguyên tử Na (Z = 11) bị mất đi 1e thì cấu hình e tương ứng của nó là
Đáp án C
Cấu hình electron của Na là . → Cấu hình electron của Na khi mất 1 electron là: .
Câu 8:
Ở trạng thái cơ bản, cấu hình electron nguyên tử nitơ (Z = 7) có bao nhiêu phân lớp?
Đáp án A
Cấu hình electron của N là: . Vậy cấu hình electron nguyên tử N gồm 3 phân lớp.
Câu 9:
Nguyên tử Ca (Z = 20) có số e ở lớp ngoài cùng là
Đáp án B
Cấu hình electron nguyên tử Ca là: . Vậy số e lớp ngoài cùng là 2.
Câu 10:
Nguyên tử X có tổng số hạt proton, nơtron và electron là 115. Ngoài ra số khối của X là 80. Số lớp electron và số electron lớp ngoài của X cùng lần lượt là
Đáp án B
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có hệ phương trình:
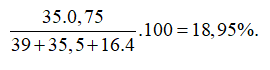
Cấu hình electron nguyên tử X là: . Vậy X có 4 lớp electron và 7electron lớp ngoài cùng.
Câu 12:
Cho nguyên tử nguyên tố X có 12 proton và 12 nơtron. Kí hiệu nguyên tử đúng của X là?
Đáp án B
Số khối A = 12 + 12 = 24.
Số hiệu nguyên tử Z = số proton = 12.
Kí hiệu nguyên tử là
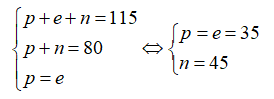
Câu 14:
Cho cấu hình electron của Fe (Z = 26): . Hỏi Fe thuộc loại nguyên tố gì?
Đáp án B
Theo trật tự phân mức năng lượng, electron cuối cùng điến vào phân lớp d.
Câu 15:
Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố R là
Đáp án D
Cấu hình electron của R là [Ne].
Vậy số hiệu nguyên tử của R = số electron của R = 15.
Câu 16:
Một nguyên tố X có 2 đồng vị có tỉ lệ số nguyên tử là 27/23. Hạt nhân của X có 35 proton. Đồng vị thứ nhất có 44 nơtron. Đồng vị thứ hai có nhiều hơn đồng vị thứ nhất là 2 nơtron. Nguyên tử khối trung bình của nguyên tố X là
Đáp án C
Số khối của đồng vị thứ nhất là: 79
Số khối của đồng vị thứ hai là: 79 + 2 = 81.
Một cách gần đúng, coi số khối xấp xỉ nguyên tử khối.
Nguyên tử khối trung bình của X là:
Câu 17:
Trong tự nhiên, nguyên tố đồng có hai đồng vị là và . Nguyên tử khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của đồng vị là
Đáp án A
Gọi x và y lần lượt là % số nguyên tử của hai đồng vị và .
Ta có:
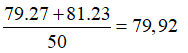
Câu 18:
Có các nguyên tố hóa học: Cr (Z = 24), Fe (Z = 26), P (Z = 15), Al (Z = 13). Nguyên tố mà nguyên tử của nó có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là
Đáp án D
Ta có cấu hình electron nguyên tử của các nguyên tố là:
Cr: [Ar] → 1e lớp ngoài cùng.
Fe: [Ar] → 2e lớp ngoài cùng.
P: [Ne]3s23p3→ 5e lớp ngoài cùng.
Al: [Ne] → 3e lớp ngoài cùng.
Nguyên tố có số electron lớp ngoài cùng lớn nhất ở trạng thái cơ bản là P.
Câu 19:
Cấu hình electron nào sau đây là của kim loại
Đáp án D
Nguyên tử có 1,2,3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại.
Ta có cấu hình e: → 2 e lớp ngoài cùng.
Câu 20:
Có 3 nguyên tử: . Những nguyên tử nào là đồng vị của một nguyên tố?
Đáp án C
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron.
X và Z cùng số proton.
Câu 22:
Ion có 18 electron và 16 proton mang điện tích là
Đáp án B
Ion có số electron > số proton → mang điện tích âm.
Số đơn vị điện tích âm là 18 – 16 = 2.
Vậy ion mang điện tích .
Câu 23:
Kí hiệu nguyên tử biểu thị đầy đủ đặc trưng cho một nguyên tử của một nguyên tố hoá học vì nó cho biết
Đáp án D
Câu 24:
Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
Đáp án B
Sự khác nhau về số nơtron tạo ra các đồng vị của cùng một nguyên tố.
Câu 25:
Trên vỏ nguyên tử, các electron chuyển động xung quanh hạt nhân................
Hãy chọn cụm từ thích hợp đối với chỗ trống ở trên.
Đáp án B
Các electron chuyển động xung quanh hạt nhân với vận tốc lớn và không theo quỹ đạo xác định.
Câu 26:
Trong tự nhiên Kali có ba đồng vị: ( = 93,258%); ( %); ( %). Biết nguyên tử khối trung bình của kali là 39,13. Giá trị của và lần lượt là
Đáp án A
Câu 28:
Nguyên tử của nguyên tố nào sau đây có số hạt nơtron nhỏ nhất?
Đáp án A
Số nơtron của F là 19 – 9 = 10.
Số nơtron của Ca, K và Sc đều là 20.
Câu 29:
Cho Mg có hai đồng vị ; . Cho Clo có hai đồng vị ; . Hỏi có tối đa bao nhiêu công thức dạng ?
Đáp án A
Các công thức có thể có là: ; ; ; ; ;
