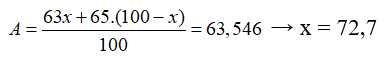Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 1 - Đề 2)
-
1638 lượt thi
-
10 câu hỏi
-
15 phút
Danh sách câu hỏi
Câu 1:
Trong nguyên tử, hạt không mang điện là
Chọn D
Trong nguyên tử hạt không mang điện là nơtron.
Câu 2:
Ion có 18 electron và 16 proton mang điện tích là
Chọn B
Hạt electron nhiều hơn hạt proton là 2 hạt. Vậy electron mang điện tích 2-.
Câu 3:
Tổng số hạt p, n, e trong nguyên tử là
Chọn B
Số hạt p = e = 9, số n = A-p = 19 – 9 = 10.
Tổng số hạt p + n + e = 9 + 9 + 10 = 28.
Câu 4:
Cho cấu hình electron nguyên tử các nguyên tố sau
a)
b)
c)
d)
e)
Cấu hình của các nguyên tố phi kim là
Chọn D
Nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
a) 1e lớp ngoài cùng
b) 7e lớp ngoài cùng
c) 3e lớp ngoài cùng
d) 2e lớp ngoài cùng
e) 6e lớp ngoài cùng
Vậy b và e là cấu hình electron nguyên tử của các nguyên tố phi kim.
Câu 5:
Nguyên tử khối trung bình của đồng là 63,546. Đồng tồn tại trong tự nhiên với 2 đồng vị là và . Thành phần trăm theo số nguyên tử của là
Chọn D
Ta có, gọi % của đồng vị , thì % đồng vị
Vậy %là 27,3%.
Câu 6:
Nguyên tử nguyên tố X có tổng số hạt bằng 82, hạt mang điện nhiều hơn hạt không mang điện là 22 hạt. Số khối A của nguyên tử X là
Chọn C
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 82:
p + e + n = 82 hay 2p + n = 82 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 22 hạt:
(p+e) – n = 22 hay 2p – n = 22 (2)
Giải (1), (2) ta có p = e = 26; n = 30
Số khối của X là A = z + n = p + n = 56.
Câu 7:
Số nguyên tố thuộc chu kỳ 3 là
Chọn A
Các chu kì 3 là chu kì nhỏ, có 8 nguyên tố trong chu kì 3.
Câu 8:
Cho nguyên tố X có số hiệu nguyên tử là 17, vị trí của nguyên tố X trong bảng tuần hoàn các nguyên tố hoá học là
Chọn A
Cấu hình electron nguyên tử X : [Ne]
X thuộc ô 17 do có z = 17, chu kỳ 3 do có 3 lớp electron, nhóm VIIA do 7 electron lớp ngoài cùng, nguyên tố p.
Câu 9:
Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì
Chọn C
Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì trong một chu kỳ các nguyên tố thuộc nhóm VIIA có tính phi kim mạnh nhất. Xét trong nhóm VIIA thì nguyên tố đứng đầu nhóm sẽ có tính phi kim mạnh nhất. Vậy Flo có tính phi kim mạnh nhất.
Câu 10:
Nguyên tố R thuộc chu kì 3, nhóm VIIA trong bảng tuần hoàn. Công thức oxit cao nhất của R là
Chọn B
R thuộc nhóm VIIA nên có 7e lớp ngoài cùng. Trong công thức oxit cao nhất của R, R có hóa trị VII.
Vậy công thức oxit cao nhất của R là