Tốc độ phản ứng hóa học
-
403 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng sau:
CaCO3 (r) + 2HCl(dd) → CaCl2 + H2O + CO2 ↑
Trả lời:
Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Nhiệt độ: nếu nhiệt độ tăng thì tốc độ phản ứng tăng.
+ Chất xúc tác: nếu thêm chất xúc tác thì khí CO2 thoát ra nhanh hơn =>Tốc độ phản ứng tăng.
+ Diện tích tiếp xúc: CaCO3 ở dạng hạt nhỏ phản ứng xảy ra nhanh hơn CaCO3 ở dạng khối =>Khi tăng diện tích tiếp xúc thì tốc độ phản ứng tăng.
+ Áp suất không ảnh hưởng đến tốc độ phản ứng trên vì phản ứng trên không có chất khí tham gia phản ứng.
Đáp án cần chọn là: C
Câu 2:
Nội dung nào thể hiện trong các câu sau đây là sai ?
Trả lời:
Nội dung A đúng vì khi đó nhiệt độ giảm nên tốc độ phản ứng phân hủy thực phẩm giảm, thực phẩm giữ được lâu hơn.
Nội dung B đúng vì tăng áp suất tốc độ phản ứng tăng.
Nội dung C đúng vì tăng nồng độ chất phản ứng thì tốc độ phản ứng tăng.
Nội dung D sai vì ở tầng khí quyển trên cao khí oxi loãng hơn so với mặt đất nên nhiên liệu cháy chậm hơn.
Đáp án cần chọn là: D
Câu 3:
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC). Trường hợp nào tốc độ phản ứng không đổi ?
Trả lời:
A. Thay bằng kẽm bột giúp tăng diện tích tiếp xúc bề mặt nên tăng tốc độ
B. Thay nồng độ H2SO4 bằng 2M làm giảm nồng độ → giảm tăng tốc độ phản ứng
C. Tăng nhiệt độ đến 50oC → tăng tốc độ phản ứng
D. Không thay đổi vì chỉ nồng độ mol H2SO4 mới ảnh hưởng, còn thể tích không ảnh hưởng
Đáp án cần chọn là: D
Câu 4:
Hai nhóm học sinh làm thí nghiệm nghiên cứu tốc độ phản ứng kẽm với dung dịch axit clohiđric:
• Nhóm thứ nhất: Cân 1 gam kẽm miếng và thả vào cốc đựng 200 ml dung dịch axit HCl 2M
• Nhóm thứ hai: Cân 1 gam kẽm bột và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do:
Trả lời:
A. Sai vì cả hai nhóm dùng nồng độ HCl như nhau là 2M
B. Đúng
C. Sai, vì kẽm bột là chất rắn nên không có nồng độ
D. Sai
Đáp án cần chọn là: B
Câu 5:
Có hai cốc chứa dung dịch Na2SO3, trong đó cốc A có nồng độ lớn hơn cốc B. Thêm nhanh cùng một lượng dung dịch H2SO4 cùng nồng độ vào hai cốc. Hiện tượng quan sát được trong thí nghiệm trên là
Trả lời:
Cốc A có nồng độ lớn hơn cốc B, nên khi cho cùng nồng độ dd H2SO4 vào 2 cốc thì cốc A sẽ có tốc độ phản ứng nhanh hơn cốc B.
→ cốc A xuất hiện kết tủa nhanh hơn cốc B.
Đáp án cần chọn là: B
Câu 6:
Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây?
Trả lời:
A. Loại, đốt trong lò kín giúp hạn chế sự tiếp xúc với O2 → củi khó cháy hơn
B. Loại, xếp củi chặt làm diện tích tiếp xúc của củi với không khí giảm → giảm khả năng cháy của củi
C. Loại, thổi hơi nước giúp giảm nhiệt độ cháy → giảm khả năng cháy của củi
D. Chọn, thổi không khí khô giúp tăng nồng độ O2, củi cháy dễ dàng hơn
Đáp án cần chọn là: D
Câu 7:
Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng:
(1) Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang).
(2) Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống.
(3) Nghiền nguyên liệu trước khi nung để sản xuất clanhke.
(4) Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2.
Trong các biện pháp trên, có bao nhiêu biện pháp đúng?
Trả lời:
(1) đúng vì dùng khí nén, nóng để tăng áp suất và nhiệt độ giúp than cốc cháy tốt hơn
(2) đúng vì tăng nhiệt độ phản ứng giúp đá vôi phân hủy nhanh hơn.
(3) đúng vì nghiền nhỏ giúp tăng diện tích tiếp xúc của nguyên liệu giúp tăng tốc độ phản ứng
(4) đúng vì chất xúc tác bột Fe giúp tăng tốc độ phản ứng
→ 4 phát biểu đều đúng
Đáp án cần chọn là: D
Câu 8:
Người ta đã sử dụng nhiệt độ của phản ứng đốt cháy than đá để nung vôi, biện pháp kỹ thuật nào sau đây không được sử dụng để tăng tốc độ phản ứng nung vôi?
Trả lời:
PTHH: CaCO3 (rắn) t0→→t0CaO (rắn) + CO2 (khí)
A. Đập nhỏ đá vôi giúp đá vôi có diện tích tiếp xúc lớn hơn, dễ nhiệt phân hơn → tăng tốc độ pư
B. Tăng nhiệt độ giúp phản ứng xảy ra nhanh hơn → tăng tốc độ pư
C. CO2 là sản phẩm tạo thành, do vậy tăng nồng độ CO2 dẫn đến không làm tăng được tốc độ pư
D. Thổi không khí nén vào bình giúp tăng áp suất và nhiệt độ → tăng tốc độ pư
Đáp án cần chọn là: C
Câu 9:
Phương pháp nào sau đây làm giảm tốc độ phản ứng?
Trả lời:
A. Nấu thực phẩm trong nồi áp suất giúp thời gian thức ăn chín nhanh và nhừ hơn → tăng tốc độ phản ứng
B. Tăng nồng độ Oxi giúp lưu huỳnh cháy nhanh hơn → tăng tốc độ phản ứng
C. Tăng áp suất và nhiệt độ giúp than cốc cháy nhanh hơn → tăng tốc độ phản ứng
D. Đóng nắp làm giảm nồng độ oxi làm than khó tiếp tục cháy → giảm tốc độ phản ứng
Đáp án cần chọn là: D
Câu 10:
Chất xúc tác trong phản ứng hóa học có tác dụng làm tăng tốc độ phản ứng, sau khi phản ứng sau chất xúc tác sẽ:
Trả lời:
Chất xúc tác có tác dụng làm tăng tốc độ phản ứng, sau khi phản ứng chất xúc tác còn nguyên, khối lượng không thay đổi
Đáp án cần chọn là: D
Câu 11:
Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng bột mịn, mẫu 2 dạng viên nhỏ, mẫu 3 dạng khối vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
Trả lời:
Khi tăng diện tích tiếp xúc của các chất phản ứng thì tốc độ phản ứng tăng.
Mà diện tích tiếp xúc của dạng bột mịn >dạng viên nhỏ >dạng khối.
Do đó tốc độ phản ứng của đá vôi dạng bột mịn >dạng viên nhỏ >dạng khối.
Khi tăng tốc độ phản ứng thì thời gian phản ứng sẽ giảm.
Do đó t1 < t2 < t3
Đáp án cần chọn là: B
Câu 12:
Cho phản ứng hóa học sau:
\[4N{H_{3\left( k \right)}} + 3{O_{2\left( k \right)}}\mathop \leftrightarrow \limits_{{v_n}}^{{v_t}} 2{N_{2\left( k \right)}} + 6{H_2}{O_{\left( h \right)}},\Delta H < 0\]
Có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng trên trong số các yếu tố sau: nhiệt độ, nồng độ, áp suất, diện tích tiếp xúc, chất xúc tác.
Trả lời:
Tất cả các yếu tố trên đều ảnh hưởng đến tốc độ phản ứng.
Đáp án cần chọn là: A
Câu 13:
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng yếu tố nào sau đây để tăng tốc độ của phản ứng?
Trả lời:
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng diện tích bề mặt chất phản ứng để tăng tốc độ của phản ứng
Đáp án cần chọn là: C
Câu 14:
Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng sau:
\[2Kcl{O_3}\left( r \right)\mathop \to \limits_{}^{t^\circ } 2Kcl\left( r \right) + 3{O_2}\left( k \right)\]
Trả lời:
Yếu tố áp suất chỉ ảnh hưởng đến chuyển dịch cân bằng chứ không làm tăng tốc độ phản ứng
Đáp án cần chọn là: C
Câu 15:
Cho phản ứng:
Na2S2O3 (l) + H2SO4 (l) → Na2SO4 (l) + SO2 (k) + S (r) + H2O (l).
Khi thay đổi một trong các yếu tố: (1) tăng nhiệt độ; (2) tăng nồng độ Na2S2O3; (3) giảm nồng độ H2SO4; (4) giảm nồng độ Na2SO4; (5) giảm áp suất của SO2; (6) dùng chất xúc tác. Có bao nhiêu yếu tố làm tăng tốc độ của phản ứng đã cho?
Trả lời:
Các yếu tố thỏa mãn: (1) ; (2) ; (6)
Đáp án cần chọn là: B
Câu 16:
Có hai mẫu đá vôi:
Mẫu 1: đá vôi có dạng khối.
Mẫu 2: đá vôi có dạng hạt nhỏ.
Hòa tan cả hai mẫu đá vôi bằng cùng một thể tích dung dịch HCl dư có cùng nồng độ. Ta thấy thời gian để mẫu 1 phản ứng hết nhiều hơn mẫu 2. Thí nghiệm trên chứng minh điều gì?
Trả lời:
Mẫu 2 chứa đá vôi có dạng hạt nhỏ, mẫu 1 chứa đá vôi dạng khối
⟹ Diện tích tiếp xúc của mẫu 2 với dung dịch HCl lớn hơn mẫu 1.
⟹ Mẫu 2 tan nhanh hơn trong dung dịch HCl so với mẫu 1.
Vậy thí nghiệm này chứng minh tốc độ phản ứng phụ thuộc vào diện tích tiếp xúc giữa các chất phản ứng.
Đáp án cần chọn là: B
Câu 17:
Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nồng độ chất phản ứng.
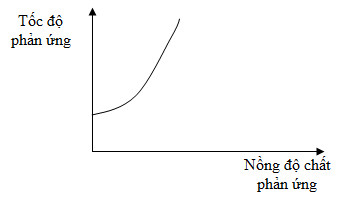
Từ đồ thị trên, ta thấy tốc độ phản ứng
Trả lời:
Theo đồ thị ta thấy khi nồng độ chất phản ứng tăng, tốc độ phản ứng tăng.
Đáp án cần chọn là: C
Câu 18:
Cho phản ứng:
X → Y
Tại thời điểm t1 nồng độ của chất X bằng C1, tại thời điểm t2 (với t2>t1), nồng độ của chất X bằng C2. Tốc độ trung bình của phản ứng trong khoảng thời gian trên được tính theo biểu thức nào sau đây ?
Trả lời:
Vì C1 >C2; t2 >t1 => \[\overline v = \frac{{{C_1} - {C_2}}}{{{t_2} - {t_1}}}\]
Đáp án cần chọn là: C
Câu 19:
Cho phản ứng hóa học sau :
\[2{H_2}{O_2}\left( l \right)\mathop \to \limits^{Mn{O_2}} 2{H_2}{O_{\left( l \right)}} + {O_{2\left( k \right)}}\]
Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng trên ?
Trả lời:
Các yếu tố ảnh hưởng đến tốc độ của phản ứng trên :
- Nồng độ H2O2 : nếu tăng nồng độ H2O2 thì tốc độ phản ứng tăng.
- Thêm chất xúc tác : làm tăng tốc độ của phản ứng.
- Nhiệt độ : nếu tăng nhiệt độ thì tốc độ phản ứng tăng.
→ Yếu tố không ảnh hưởng đến tốc độ của phản ứng là áp suất vì chất tham gia không phải là chất khí.
Đáp án cần chọn là: A
Câu 20:
Cho phản ứng: 2NO + O2 → 2NO2 xảy ra trong bình kín. Biết nhiệt độ của hệ không đổi. Tốc độ của phản ứng tăng hay giảm bao nhiêu lần khi áp suất của NO tăng 3 lần ?
Trả lời:
Gọi k là hằng số tốc độ phản ứng
→ Công thức tính tốc độ phản ứng theo k:
v1 = k([NO])2[O2]
- Khi tăng áp suất của NO lên 3 lần → Nồng độ của NO tăng lên 3 lần, nồng độ của O2 không đổi nên
v2 = k(3[NO])2[O2]1 = k.9.([NO])2[O2]
\[ \to \frac{{{v_2}}}{{{v_1}}} = \frac{{k.9.{{\left( {\left[ {NO} \right]} \right)}^2}\left[ {{O_2}} \right]}}{{k{{\left( {\left[ {NO} \right]} \right)}^2}\left[ {{O_2}} \right]}} = 9\]
\[ \to {v_2} = 9{v_1}\]
→ Tốc độ phản ứng tăng lên 9 lần
- Ngược lại: Khi giảm áp suất của NO xuống 3 lần
→ Nồng độ của NO giảm đi 3 lần, nồng độ của O2 không đổi
\[{v_2} = k{\left( {\frac{{\left[ {NO} \right]}}{3}} \right)^2}{\left[ {{O_2}} \right]_1} = k.\frac{{{{\left( {\left[ {NO} \right]} \right)}^2}}}{9}\left[ {{O_2}} \right]\]
\[ \to \frac{{{v_2}}}{{{v_1}}} = \frac{{k.\frac{{{{\left( {\left[ {NO} \right]} \right)}^2}}}{9}\left[ {{O_2}} \right]}}{{k{{\left( {\left[ {NO} \right]} \right)}^2}\left[ {{O_2}} \right]}} = \frac{1}{9}\]
\[ \to {v_2} = \frac{{{v_1}}}{9}\]
→ Tốc độ phản ứng giảm đi 9 lần
Đáp án cần chọn là: A
Câu 21:
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây là
Trả lời:
\[4N{H_{3\left( k \right)}} + 3{O_{2\left( k \right)}}\mathop \leftrightarrow \limits_{{v_n}}^{{v_t}} 2{N_{2\left( k \right)}} + 6{H_2}{O_{\left( h \right)}},\Delta H < 0\]2H2
O2 MnO2−−−→→MnO2 2H2O + O2+) Theo phương trình phản ứng :
\[{n_{{H_2}{O_2}phan\,ung}} = 2{n_{{O_2}}} = 2.0,0015 = 0,003mol\]
+) Lượng H2O2 phản ứng này chính là lượng H2O2 biến đổi trong 60 giây
hay \[\Delta C = \frac{{0,003}}{{0,1}} = 0,03mol/L\]
+) \[\overrightarrow v = \frac{{\Delta C}}{{\Delta t}}\] nên \[\overrightarrow v = \frac{{0,03}}{{60}} = {5.10^{ - 4}}mol/(L.s)\]
Đáp án cần chọn là: C
Câu 22:
Cho phản ứng: 2SO2 + O2 ⇆ 2SO3. Biết thể tích bình phản ứng không đổi. Tốc độ phản ứng tăng lên 4 lần khi
Trả lời:
Gọi k là hằng số tốc độ phản ứng
=> Công thức tính tốc độ phản ứng theo k: v = k[SO2]2[O2]
- Khi tăng nồng độ của SO2 lên 2 lần thì tốc độ phản ứng tăng lên 22 = 4 lần
- Khi tăng nồng độ của SO2 lên 4 lần thì tốc độ phản ứng tăng lên 42 = 16 lần
- Khi tăng nồng độ của O2 lên 2 lần thì tốc độ phản ứng tăng lên 2 lần
- Khi tăng đồng thời nồng độ SO2 và O2 lên 2 lần thì tốc độ phản ứng tăng lên 22.2 = 8 lần
Đáp án cần chọn là: A
Câu 23:
A2 + 2B → 2AB
Tốc độ của phản ứng thay đổi như thế nào khi áp suất của A2 tăng lên 6 lần?
Trả lời:
Gọi k là hằng số tốc độ phản ứng.
→ Công thức tính tốc độ phản ứng theo k: v1 = k[A2]([B])2
Khi áp suất của A2 tăng lên 6 lần thì nồng độ của A2 tăng lên 6 lần và nồng độ của B không đổi thì:
v2 = k.6.[A2]([B])2
\[ \to \frac{{{v_2}}}{{{v_1}}} = \frac{{k.6.\left[ {{A_2}} \right]{{\left( {\left[ B \right]} \right)}^2}}}{{k\left[ {{A_2}} \right]{{\left( {\left[ B \right]} \right)}^2}}} = 6\]
\[ \to {v_2} = 6{v_1}\]
→ Tốc độ phản ứng tăng lên 6 lần.
Đáp án cần chọn là: A
Câu 24:
Cho phương trình hóa học của phản ứng:
X + 2Y → Z + T.
Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là
Trả lời:
Tốc độ trung bình của phản ứng :
\[\overline v = \frac{{\Delta C}}{{\Delta t}} = \frac{{0,01 - 0,008}}{{20}} = {10^{ - 4}}mol/(L.s)\]
Đáp án cần chọn là: C
Câu 25:
Trả lời:
Gọi nhiệt độ của phản ứng trước và sau khi tăng là t1, t2.
+) Tốc độ phản ứng tăng lên 1024 lần nên \[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = 1024\]
mà \[{v_{{t_2}}} = {v_{{t_1}}}.{k^{\frac{{{t_2} - {t_1}}}{{10}}}} \Rightarrow {k^{\frac{{{t_2} - {t_1}}}{{10}}}} = \frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = 1024\] (1)
+) Theo bài ra ta có, nhiệt độ tăng thêm nên t2 – t1 =500C
Thay vào (1) ta có\[{k^{\frac{{{t_2} - {t_1}}}{{10}}}} = 1024 \to {k^5} = {4^5} \to k = 4\]
Vậy hệ số nhiệt độ của tốc độ phản ứng là 4.
Đáp án cần chọn là: C
Câu 26:
Trả lời:
Tốc độ phản ứng tăng lên 3 lần nên \[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = 3\]
mà \[{v_{{t_2}}} = {v_{{t_1}}}.{k^{\frac{{{t_2} - {t_1}}}{{10}}}} \Rightarrow {k^{\frac{{{t_2} - {t_1}}}{{10}}}} = \frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = 3\] (1)
- Tăng nhiệt độ thêm 250C thì thì t2 – t1 = 250C
Thay vào (1) : \[{k^{\frac{{{t_2} - {t_1}}}{{10}}}} = {k^{2,5}} = 3 \to k = 1,552\]
- Khi phản ứng tăng từ 200C lên 1700C thì t2 – t1 = 1500C
\[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}.}} = k\frac{{{t_2} - {t_1}}}{{10}} = 1,{552^{15}} = 730\]
=> Tốc độ phản ứng tăng lên 730 lần.
Đáp án cần chọn là: B
Câu 27:
A. 40oC
Trả lời:
Gọi nhiệt độ của phản ứng trước và sau khi tăng là t1, t2.
+) Tốc độ phản ứng tăng lên 3 lần nên\[\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = 3\]
mà \[{v_{{t_2}}} = {v_{{t_1}}}.{k^{\frac{{{t_2} - {t_1}}}{{10}}}} \Rightarrow {k^{\frac{{{t_2} - {t_1}}}{{10}}}} = \frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = 3\] (1)
- Theo bài ra, nhiệt độ tăng thêm 100C nên t2 – t1 = 100C
Thay vào (1) ta có: \[{k^{\frac{{{t_2} - {t_1}}}{{10}}}} = 3 \to {k^1} = {3^1} \to k = 3\]
- Khi tốc độ phản ứng tăng lên 81 lần và t1 = 300C
Mà\[{k^{\frac{{{t_2} - 30}}{{10}}}} = \frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}.}} \to {3^{\frac{{{t_2} - 30}}{{10}}}} = {3^4}\]
\[ \to \frac{{{t_2} - 30}}{{10}} = 4 \to {t_2} = {70^0}C\]
=>thực hiện phản ứng ở nhiệt độ 70oC
Đáp án cần chọn là: D
Câu 28:
Trả lời:
Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu
⟹ Nồng độ H2SO4 đã phản ứng bằng 100% – 15% = 85% nồng độ ban đầu
⟹ ∆CH2SO4 = CH2SO4(pứ) = 0,05.85% = 0,0425 M.
⟹ nH2SO4 (pứ) = 0,0425.0,04 = 1,7.10-3 mol.
Tốc độ trung bình của phản ứng trong khoảng thời gian 20 giây theo H2SO4 là
\[\overline v = \frac{{0,0425}}{{20}} = 2,{125.10^{ - 3}}mol/(l.s)\]
PTHH của phản ứng xảy ra: Na2S2O3 + H2SO4 → S↓ + SO2 + H2O + Na2SO4
⟹ nS↓ = nH2SO4 pứ = 1,7.10-3 mol
Vậy khối lượng kết tủa vàng là m = mS = 1,7.10-3.32 = 0,0544 g.
Đáp án cần chọn là: D
Câu 29:
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
Trả lời:
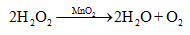
nO2 = 1,5.10-4 mol
=>nH2O2 phản ứng= 3.10-4 mol
=>∆CH2O2 = n/V = 3.10-4/0,1 = 3.10-3 M
=>v = ∆C/∆t = 3.10-3 / 60 = 5.10-5 mol/(l.s)
Đáp án cần chọn là: D
Câu 30:
Thực hiện phản ứng sau trong bình kín:
H2 (k) + Br2 (k) → 2HBr (k).
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ
trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là
Trả lời:
=>v = ∆C/∆t = (0,072 – 0,048) /1 20 = 2.10-4 mol/(l.s)
Đáp án cần chọn là: B
