Đề kiểm tra Hóa 11 giữa học kì 1 có đáp án (Mới nhất) (đề 3)
-
1239 lượt thi
-
23 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chất điện li là chất khi tan trong nước
Đáp án đúng là: D
Chất điện li là chất khi tan trong nước phân li ra ion
Câu 2:
Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động hóa học là do
Đáp án đúng là: B
Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học là do phân tử nitơ có liên kết ba khá bền
Câu 3:
Cho phản ứng: Cu + HNO3loãng Cu(NO3)2 + NO + H2O. Tổng hệ số các chất (số nguyên tối giản nhất) trong phương trình trên là
Đáp án đúng là: C
3Cu + 8HNO3loãng 3Cu(NO3)2 + 2NO + 4H2O
Tổng hệ số các chất: 3 + 8 + 3 + 2 + 4 = 20.
Câu 4:
Số oxi hóa của N trong phân tử HNO3 là
Đáp án đúng là: B
Gọi số oxi hóa của N trong HNO3 là x
→ 1 + x + (+2).3 = 0 → x = +5.
Câu 5:
Đáp án đúng là: C
(NH4)2SO4 và FeCl3 tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa.
Loại NaCl vì không phản ứng với Ba(OH)2.
Loại ZnCl2 do tạo kết tủa, sau đó kết tủa tan do kiềm dư.
Câu 6:
Đáp án đúng là: B
Al, Fe, Cr bị thụ động hóa trong axit HNO3 đặc, nguội.
Câu 7:
Một dung dịch có nồng độ [H+] = 3,0. 10-12 M. Dung dịch có môi trường
Đáp án đúng là: B
Dung dịch có [H+] = 3,0.10-12 M < 10-7 M
→ Dung dịch có môi trường bazơ.
Câu 8:
Dung dịch X có pH = 9, dung dịch Y có pH = 11. Phát biểu nào sau đây là đúng?
Đáp án đúng là: A
pHX < pHY → X có tính bazơ yếu hơn Y.Câu 9:
Khi cho giấy quỳ tím ẩm vào bình chứa khí amoniac thì giấy quỳ
Đáp án đúng là: C
Khi cho giấy quỳ tím ẩm vào bình chứa khí amoniac thì giấy quỳ chuyển sang màu xanh.
Câu 10:
Đáp án đúng là: A
Theo Areniut, bazơ là chất khi tan trong nước phân li ra OH-.
NaOH là bazơ.
NaOH → Na+ + OH-.
Câu 11:
Chất nào sau đây thuộc loại chất điện li yếu?
Đáp án đúng là: C
HF là axit yếu, là chất điện li yếu.
Câu 12:
HNO3 chỉ thể hiện tính axit khi tác dụng với các chất thuộc dãy nào dưới đây?
Đáp án đúng là: D
HNO3 chỉ thể hiện tính axit khi tác dụng với Fe(OH)3, Na2CO3, Fe2O3.
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Câu 13:
Phương trình ion thu gọn: H+ + OH- → H2O, biểu diễn bản chất của phản ứng hoá học nào sau đây?
Đáp án đúng là: D
Phương trình H2SO4 + 2KOH → K2SO4 + 2H2O có phương trình ion thu gọn là:
H+ + OH- → H2O
Câu 15:
Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để
Đáp án đúng là: A
Trong công nghiệp, phần lớn nitơ dùng để sản xuất ra amoniac, từ đó sản xuất phân đạm, axit nitric…
Câu 16:
Muối axit là muối
Đáp án đúng là: D
Muối axit là muối mà anion gốc axit còn nguyên tử hidro có khả năng phân li ra ion H+
Câu 17:
Phương trình ion thu gọn cho biết
Đáp án đúng là: D
Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch các chất điện ly.
Câu 18:
Cho hình vẽ mô tả thí nghiệm như sau:
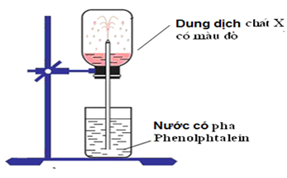
Hình vẽ mô tả thí nghiệm để chứng minh
Đáp án đúng là: B
Thí nghiệm chứng minh tính tan nhiều trong nước và tính bazơ của NH3
Câu 19:
Đáp án đúng là: A
Amoni nitrat có công thức hóa học là NH4NO3
Câu 20:
Đáp án đúng là: B
Nitơ thể hiện tính khử trong phản ứng với oxi
N2 + O2 2NO
Trong phản ứng này, số oxi hóa của nitơ tăng từ 0 lên +2.
Câu 21:
Nhóm ion nào sau đây tồn tại trong cùng một dung dịch?
Đáp án đúng là: D
Nhóm các ion tồn tại trong cùng một dung dịch là K+, Ba2+, OH-, Cl-.
Câu 22:
Một dung dịch X chứa 0,1 mol Na+, x mol Ca2+ và 0,5 mol Cl-. Tính khối lượng rắn khan thu được sau khi cô cạn cẩn thận dung dịch X.
Bảo toàn điện tích:
Bảo toàn khối lượng:
mrắn = 0,1.23 + 0,2.40 + 0,5.35,5 = 28,05 gam
Câu 23:
Hòa tan hoàn toàn 15,2 gam hỗn hợp hai kim loại gồm Fe và Cu vào dumg dịch HNO3 loãng, thu được 4,48 lít khí NO (sản phẩm khử duy nhất ở đktc) và dung dịch muối Y.
a. Tính phần trăm khối lượng mỗi kim loại có trong hỗn hợp ban đầu?
b. Nhiệt phân hoàn toàn lượng muối Y ở trên trong bình kín không chứa không khí, sau một thời gian thu được hỗn hợp khí Z. Hấp thụ hoàn toàn Z vào nước để được 6 lít dung dịch T. Tính pH của dung dịch T?
a)
Gọi số mol Cu, Fe lần lượt là x, y
→ mhh = 64x + 56y = 15,2 gam
Ta có:
Giải được x = 0,15; y = 0,1
→ mCu = 0,15.64 = 9,6 gam
→ %mFe = 36,84%
b)
→ CM(T) = 0,1M → pH = 1
