Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 1)
-
4685 lượt thi
-
17 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án B
Phương pháp giải:
Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng % K2O tương ứng với lượng kali có trong phân đó.
Giả sử có 100 gam phân bón
Tính khối lượng K2CO3 có trong phân bón, từ đó tính được số mol của K2CO3
Áp dụng bảo toàn nguyên tố K để tìm được số mol của K2O, từ đó tính được khối lượng của K2O
Tính % khối lượng của K2O và kết luận
Giải chi tiết:
Giả sử có 100 gam phân bón
Bảo toàn nguyên tố K:
Độ dinh dưỡng =
Câu 2:
Chọn đáp án A
Phương pháp giải:
Các kim loại đứng trước H trong dãy hoạt động hóa học có khả năng tham gia phản ứng với HCl
Al, Fe, Cr bị thụ động hóa trong HNO3 đặc, nguội và H2SO4 đặc, nguội.
Giải chi tiết:
Đáp án A:
Đáp án B:
Fe không phản ứng với HNO3 đặc, nguội
Đáp án C:
Al không phản ứng với HNO3 đặc, nguội
Câu 3:
Chọn đáp án D
Phương pháp giải:
- Muối nitrat của kim loại đứng trước Mg
- Muối nitrat của kim loại từ Mg đến Cu
- Muối nitrat của kim loại đứng sau Cu
Giải chi tiết:
PTHH:
Vậy sản phẩm của phản ứng nhiệt phân AgNO3 là Ag, NO2 và O2.
Câu 4:
Chọn đáp án A
Phương pháp giải:
- Nguyên tắc của phương pháp phân tích định tính: Chuyển các nguyên tố trong hợp chất hữu cơ thành chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
- Nguyên tắc của phương pháp phân tích định lượng: Cân chính xác khối lượng hợp chất hữu cơ, sau đó chuyển nguyên tố C thành CO2, H thành H2O, N thành N2, sau đó xác định chính xác khối lượng hoặc thể tích của các chất tạo thành, từ đó tính % khối lượng các nguyên tố.
Giải chi tiết:
Nguyên tắc của phương pháp phân tích định tính: Chuyển các nguyên tố trong hợp chất hữu cơ thành chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng.
Câu 5:
Chọn đáp án B
Phương pháp giải:
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, HCN, muối cacbonat, muối xianua, muối cacbua,…)
Giải chi tiết:
Đáp án A: (NH4)2CO3 và CO2 là hợp chất vô cơ
Đáp án C: CO2, K2CO3, NaHCO3 là hợp chất vô cơ
Đáp án D: NH4HCO3 là hợp chất vô cơ
Câu 6:
Chọn đáp án D
Phương pháp giải:
Than hoạt tính có khả năng hấp phụ các chất trong không khí, trong dung dịch nên được ứng dụng để làm mặt nạ phòng độc, lõi lọc nước,…
Giải chi tiết:
Để phòng nhiễm độc CO người ta dùng mặt nạ phòng độc có chứa than hoạt tính.
Câu 7:
Chọn đáp án B
Phương pháp giải:
Giải chi tiết:
Đá vôi có thành phần hóa học chính là CaCO3.
Câu 8:
Chọn đáp án D
Phương pháp giải:
- Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân
- Tất cả các muối hiđrocacbonat đều bị nhiệt phân
Giải chi tiết:
Na2CO3 là muối cacbonat tan nên không bị nhiệt phân
Câu 9:
Chọn đáp án A
Phương pháp giải:
- Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân
- Tất cả các muối hiđrocacbonat đều bị nhiệt phân
Giải chi tiết:
PTHH:
Câu 10:
Chọn đáp án C
Phương pháp giải:
PTHH tổng quát: kim loại + HNO3 → muối + sản phẩm khử + H2O
HNO3 đặc cho sản phẩm khử là NO2 (khí màu nâu đỏ)
Giải chi tiết:
Khí NO2 thoát ra có màu nâu đỏ
Dung dịch muối Cu(NO3)2 có màu xanh
Câu 11:
Đặt P trắng và P đỏ trên lá sắt và đốt bằng đèn cồn theo sơ đồ thí nghiệm dưới đây:
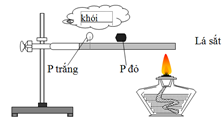
Sau một thời gian, người ta thấy P trắng bốc cháy trong không khí. Thí nghiệm này chứng tỏ
Chọn đáp án A
Phương pháp giải:
P trắng hoạt động hơn P đỏ (vì P trắng có kiểu mạng phân tử, còn P đỏ có cấu trúc polime)
Giải chi tiết:
Thí nghiệm chứng tỏ khả năng bốc cháy của P trắng dễ hơn P đỏ.
Câu 12:
Chọn đáp án B
Phương pháp giải:
Xét tỷ lệ
Nếu T ≤ 1, phản ứng chỉ tạo muối NaH2PO4
Nếu 1 < T < 2, phản ứng tạo muối NaH2PO4 và Na2HPO4
Nếu T = 2, phản ứng tạo muối Na2HPO4
Nếu 2 < T < 3, phản ứng tạo muối Na2HPO4 và Na3PO4
Nếu T ≥ 3, phản ứng tạo muối Na3PO4
Giải chi tiết:
Vì → phản ứng sinh ra 2 muối NaH2PO4 và Na2HPO4
Câu 13:
Phương pháp giải:
Khi cho từ từ dung dịch axit vào dung dịch muối cacbonat, phản ứng xảy ra theo từng nấc
Giải chi tiết:
Khi nhỏ dung dịch HCl từ từ đến dư vào dung dịch Na2CO3 ban đầu chưa xuất hiện khí, sau một lúc có khí không màu thoát ra.
Câu 14:
Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp gồm Al2O3, Fe2O3 và CuO. Sau khi phản ứng hoàn toàn, thu được chất rắn X và khí Y. Dẫn Y vào nước vôi trong dư thu được kết tủa trắng. Viết các phương trình hóa học và xác định các chất trong X và Y.
Phương pháp giải:
CO chỉ khử được oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
Giải chi tiết:
CO chỉ khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học
Al2O3 không phản ứng
Vậy chất rắn X gồm Al2O3, Fe và Cu.
Khí Y gồm CO2 và CO
Dẫn khí Y vào nước vôi trong dư:
Câu 15:
Từ ơgenol (trong tinh dầu hương nhu) điều chế được metylơgenol (M = 178 g/mol) là chất dẫn dụ côn trùng. Kết quả phân tích nguyên tố của metylơgenol cho thấy % khối lượng của các nguyên tố như sau: %C = 74,16%; %H = 7,86%, còn lại là oxi. Xác định CTPT của metylơgenol.
Phương pháp giải:
Tính % khối lượng của Oxi trong metylơgenol Gọi công thức của metylơgenol là CxHyOz Ta có: Kết luận công thức đơn giản nhất của metylơgenol Từ phân tử khối của metylơgenol, tìm công thức phân tử của metylơgenol
Giải chi tiết:
Ta có: %O = 100% - %C - %H = 100% - 74,16% - %7,86% = 17,98%
Gọi công thức phân tử của metylơgenol là CxHyOz
Vậy công thức đơn giản nhất của metylơgenol là C11H14O2
Mà Mmetylơgenol = 178 → (C11H14O2)n = 178 → (11.12 + 14.1 + 2.16)n = 178 → n = 1
Vậy công thức phân tử của metylơgenol là C11H14O2
Câu 16:
Hoà tan hoàn toàn 8,4 gam Fe vào dung dịch HNO3 đặc nóng, dư thu được V lít (đktc) khí NO2 duy nhất. Tính V.
Phương pháp giải:
Áp dụng bảo toàn electron cho phản ứng, suy ra số mol của NO2 Từ đó tìm được V.
Giải chi tiết:
Ta có:
Quá trình trao đổi electron
Fe0 → Fe+3 + 3eN+5 + 1e → N+4
Áp dụng bảo toàn electron: ne nhường = ne nhận
lit
Câu 17:
Cho 5 gam bột Mg vào dung dịch hỗn hợp KNO3 và H2SO4, đun nhẹ, trong điều kiện thích hợp, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X chứa m gam muối; 1,792 lít hỗn hợp khí Y (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và còn lại 0,44 gam chất rắn không tan. Biết tỉ khối hơi của Y đối với H2 là 11,5. Tính m?
Phương pháp giải:
Kết luận các khí có trong Y và tính số mol mỗi khí trong Y
Áp dụng bảo toàn electron, chứng minh sau phản ứng thu được muối amoni, tính số mol muối amoni.
Tìm số mol các ion K+ và SO42- thông qua H+và NO3-
Áp dụng bảo toàn khối lượng cho dung dịch X và tìm m.
Giải chi tiết:
Hỗn hợp khí Y gồm NO (x mol) và H2 (y mol)
(1)
(2)
Từ (1) và (2)
Ta có mMg phản ứng = 5 – 0,44 = 4,56 gam
Quá trình trao đổi electron:
Mg0 → Mg+2 + 2e 4H+ + NO3- + 3e → NO + 2H2O
0,19 → 0,38 0,24 ← 0,06 ← 0,18 ← 0,06
10H+ + NO3- + 8e → NH4+ + 3H2O
0,2 ← 0,02 ← 0,16 → 0,02
2H+ + 2e → H2
0,04 ← 0,04 ← 0,02
Ta thấy: ne nhường = 2nMg phản ứng = 0,38 mol ≠ ne nhận = 3nNO + 2nH2 = 3.0,06 + 2.0,02 = 0,22
→ Phản ứng có tạo muối amoni
Dung dịch X chứa Mg2+(0,19 mol), K+ (0,08 mol), SO42- (0,24 mol), NH4+ 0,02 mol
