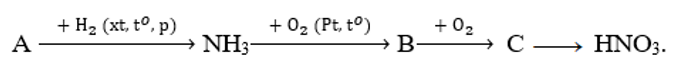Trắc nghiệm Chuyên đề Hóa 11 Đề kiểm tra học kì 1 (có đáp án) - Đề 1
-
796 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chất nào sau đây là chất điện li mạnh trong dung môi nước?
Đáp án D
NaCl là muối tan trong nước nên là chất điện li mạnh trong dung môi nước.
Câu 2:
Cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 thấy có hiện tượng:
Đáp án B
3NaOH + AlCl 3 → Al(OH)3 (↓ keo trắng) + 3NaCl
Al(OH)3 ↓ + NaOH → NaAlO2 (dd) + H2O.
Câu 3:
Hòa tan hoàn toàn 2 muối X, Y vào nước thu được dung dịch chứa 0,15 mol Al3+; 0,1 mol K+; 0,05 mol SO42-; 0,45 mol Br-. Hai muối X, Y đó là
Đáp án B
Ta có:
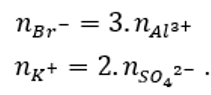
Vậy hai muối X và Y là AlBr3 và K2SO4.
Câu 4:
Cho các chất: Ca(HCO3)2, NH4Cl, (NH4)2CO3, ZnSO4, Al(OH)3, Zn(OH)2. Số chất trong dãy có tính chất lưỡng tính là
Đáp án C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra H+.
KHCO3 → K+ + HCO3-
HCO3- ⇌ H+ + CO32-
Câu 5:
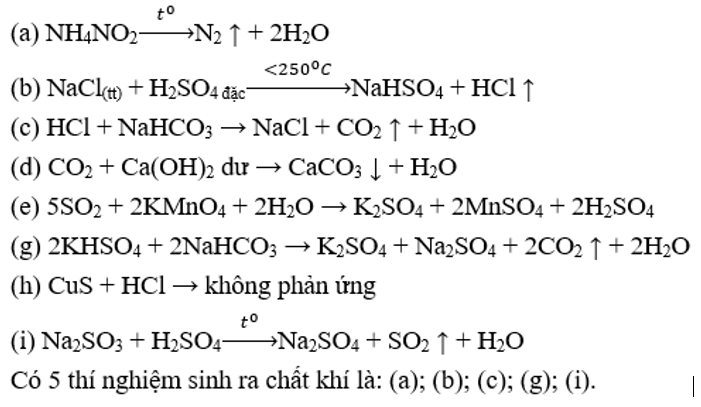
Thực hiện các thí nghiệm sau:
(a) Nung NH4NO2 rắn.
(b) Đun nóng NaCl tinh thể với dung dịch H2SO4 (đặc).
(c) Nhỏ HCl vào dung dịch NaHCO3.
(d) Sục khí CO2 vào dung dịch Ca(OH)2 (dư).
(e) Sục khí SO2 vào dung dịch KMnO4.
(g) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(h) Cho CuS vào dung dịch HCl (loãng).
(i) Cho Na2SO3 vào dd H2SO4 (dư), đun nóng.
Số thí nghiệm sinh ra chất khí là
Đáp án C
Câu 6:
Thêm 180 ml dung dịch NaOH 2M vào một cốc đựng 100 ml dung dịch AlCl3 nồng độ x mol/l, sau khi phản ứng hoàn toàn thấy trong cốc có 9,36 gam chất kết tủa. Thêm tiếp 140 ml dung dịch NaOH 2M vào cốc, sau khi phản ứng hoàn toàn thấy trong cốc có 12,48 gam chất kết tủa.Giá trị của x là
Đáp án D
Theo bài ra thấy giai đoạn 1 NaOH hết, AlCl3 dư kết tủa chưa tan:
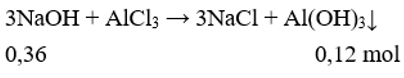
Giai đoạn 2, kết tủa đạt cực đại sau đó tan một phần:
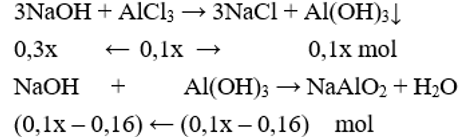
Có nNaOH = 0,3x + (0,1x – 0,16) = 0,18.2 + 0,14.2 → x = 2.
Câu 7:
Cho 200 ml dung dịch H3PO4 1M tác dụng với 250 ml dung dịch NaOH 2M. Khối lượng muối thu được sau phản ứng là
Đáp án C
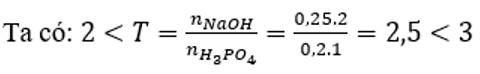
Sau phản ứng thu được hai muối: Na2HPO4 (x mol) và Na3PO4 (y mol)
Bảo toàn Na có: 2x + 3y = 0,5 (1)
Bảo toàn P có: x + y = 0,2 (2)
Từ (1) và (2) có x = y = 0,1.
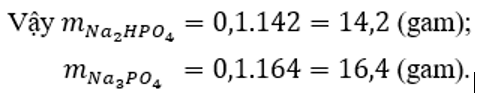
Câu 8:
Sục 2,688 lít CO2 (đktc) vào 40ml dung dịch Ca(OH)2 2M. Sau phản ứng thu được dung dịch gồm:
Đáp án D
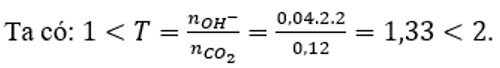
Vậy sau phản ứng thu được 2 muối là CaCO3 và Ca(HCO3)2.
Câu 9:
Một hỗn hợp X gồm Fe2O3, FeO và Al2O3 có khối lượng là 9,02 gam, trong đó Al2O3 chiếm 5,1 gam. Cho X phản ứng với lượng dư CO,đun nóng. Sau khi phản ứng kết thúc, ta được chất rắn Y và hỗn hợp khí gồm CO và CO2. Cho hỗn hợp khí này qua nước vôi trong thu được 5 gam kết tủa. Lọc tách kết tủa, dung dịch còn lại đem đun nóng thu thêm được 1 gam kết tủa nữa. Phần trăm khối lượng của oxit sắt có phân tử khối nhỏ hơn trong hỗn hợp ban đầu gần nhất với
Đáp án A
Gọi số mol của Fe2O3 và FeO lần lượt là x và y (mol)
Theo bài ra: mX = 9,02 → 160x + 72y + 5,1 = 9,02 → 160x + 72y = 3,92 (1)
Cho X phản ứng với CO dư, đun nóng Al2O3 không phản ứng.
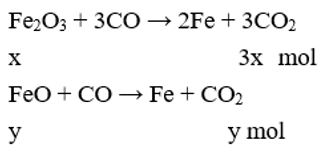
Cho hỗn hợp khí qua nước vôi trong chỉ CO2 phản ứng
Theo bài ra:
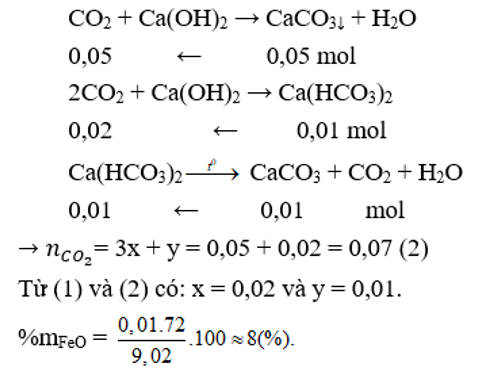
Câu 10:
Cho 4,86 gam kim loại X tác dụng hoàn toàn với HNO3, thu được 4,032 lít NO (ở đktc) là sản phẩm khử duy nhất. Kim loại X là
Đáp án C
Gọi hóa trị cao nhất của X là n (n = 1,2 hoặc 3)
Áp dụng định luật bảo toàn electron ta có:
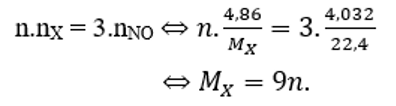
Vậy n = 3, MX = 27 hay X là Al thỏa mãn.
Câu 11:
Khí amoniac làm giấy quỳ tím ẩm
Đáp án A
Khí amoniac làm giấy quỳ tím ẩm chuyển sang màu xanh.
Câu 12:
Dãy muối nitrat khi nhiệt phân tạo thành oxit kim loại, khí NO2 và O2 là
Đáp án C
Muối của kim loại hoạt động trung bình ( từ Mg → Cu trong dãy hoạt động hóa học của kim loại) khi nhiệt phân tạo thành oxit kim loại, khí NO2 và O2.
Câu 13:
Công thức hoá học của supephotphat kép là
Đáp án D
Supephotphat kép là Ca(H2PO4)2.
Câu 14:
Phản ứng được sử dụng trong việc khắc chữ lên thủy tinh là
Đáp án D
HF có thể ăn mòn thủy tinh nên được ứng dụng để khắc chữ lên thủy tinh.
PTHH: SiO2 + 4HF → SiF4 + 2H2O.
Câu 15:
Dãy các kim loại được điều chế khi dùng CO để khử oxit kim loại tương ứng ở nhiệt độ cao là
Đáp án A
CO khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại.
Câu 16:
Cho các chất: FeCO3, Fe3O4, MgO, FeO, Fe2O3, Al2O3, Fe, CuO. Số chất tác dụng với HNO3 đặc nóng tạo ra khí màu nâu đỏ là
Đáp án C
Các chất tác dụng với HNO3 đặc nóng tạo ra khí màu nâu đỏ là: FeCO3; Fe3O4; FeO; Fe.
Câu 18:
Trong các phản ứng hoá học sau, phản ứng nào không xảy ra ?
Đáp án C
Phản ứng C sai vì CO chỉ khử được oxit của kim loại đứng sau nhôm trong dãy hoạt động hóa học của kim loại.
Câu 19:
Đốt cháy hoàn toàn m gam hợp chất hữu cơ X cần vừa đủ 5,04 lít O2 (đktc). Hấp thụ sản phẩm cháy vào dung dịch Ca(OH)2 dư, thu được 15 gam kết tủa. Dung dịch còn lại có khối lượng giảm so với khối lượng của dung dịch Ca(OH)2 là 4,8 gam. Tỉ khối hơi của X so với H2 nhỏ hơn 40. Công thức phân tử của X là
Đáp án B
Theo đáp án, đặt công thức tổng quát của X là CxHyOZ
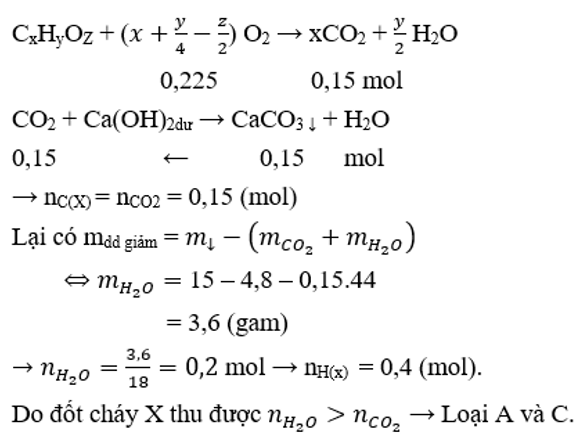
Bảo toàn O có nO(X) = 0,15.2 + 0,2 – 2.0,225 = 0,05 (mol)
Có x : y : z = nC : nH : nO = 0,15 : 0,4 : 0,05 = 3 : 8 : 1
Vậy công thức phân tử của X là (C3H8O)n
Có MX < 40.2 = 80 → 76n < 80 → n = 1 thỏa mãn.
Vậy X là C3H8O.
Câu 20:
Cho a gam bột Fe vào 400 ml dung dịch hỗn hợp gồm Cu(NO3)20,3M và H2SO40,25M. Sau khi cácphản ứng xảy ra hoàn toàn, thu được 0,6a gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của a và V lần lượt là
Đáp án C
Do sau phản ứng thu được hỗn hợp kim loại nên có các phản ứng:
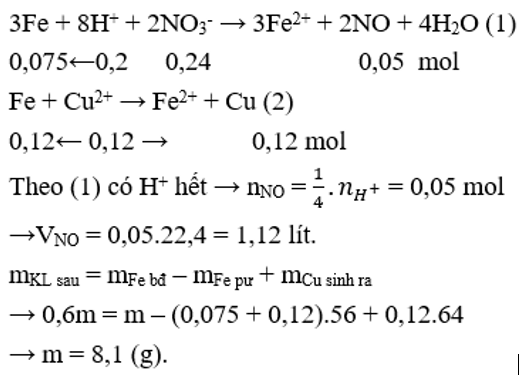
Câu 21:
Nung một hợp chất hữu cơ X với lượng dư chất oxi hóa CuO, người tathu được khí CO2, hơi H2O và khí N2. Kết luận nào sau đây chính xác?
Đáp án A
Do sau khi nung X với CuO thu được CO2, H2O và N2 nên trong X chứa C, H, N và có thể có O.
Câu 22:
Chọn phát biểu đúng?
Đáp án A
B sai vì dung dịch có pH < 7 làm quỳ tím hóa đỏ.
C sai vì dung dịch có pH > 7 làm quỳ tím hóa xanh.
D sai vì giá trị pH tăng thì độ axit giảm.
Câu 23:
Ion OH- phản ứng được với dãy các ion:
Đáp án D
H+ + OH- → H2O
NH4++ OH- ⇌ NH3 + H2O
HCO3-+ OH- → CO32- + H2O
Câu 24:
Cho lượng dư bột kẽm vào dung dịch hỗn hợp gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối và 2,688 lít hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 11,5. Giá trị của m là
Đáp án D
Khí không màu hóa nâu trong không khí là NO.
Lại có MY= 11,5.2 = 23 → Khí còn lại là H2.
Vậy Y gồm H2 (x mol) và NO (y mol).
Ta có:
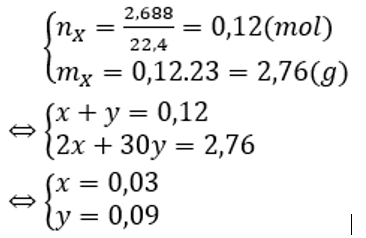
Vì có khí H2 thoát ra và Zn dư → H+ và NO3- hết → Muối thu được là muối clorua.
Do nNO3- ban đầu = 0,15 mol > nNO = 0,09 mol→ X chứa NH4+.
Bảo toàn nguyên tố N → nNH4+= 0,15- 0,09= 0,06(mol)
Bảo toàn electron: 2.nZn pứ = 3.nNO+ 8nNH4++ 2nH2 → nZn pứ = nZn2+ = 0,405 mol
→ m = mZnCl2 + mNH4Cl + mNaCl+ mKCl
= 136. 0,405 + 53,5.0,06 + 58,5.0,05+ 74,5.0,1
= 68,655 gam.
Câu 25:
Cho phương trình ion: FeS + H++SO42- → Fe3++ SO2 + H2O. Tổng hệ số nguyên tối giản củaphương trình ion này là
Đáp án B
2FeS + 20H++ 7SO42- → 2Fe3++ 9SO2 + 10H2O
Tổng hệ số cân bằng = 2 + 20 + 7 + 2 + 9 + 10 = 50.
Câu 26:
Dãy gồm các chất tác dụng được với dung dịch Ba(HCO3)2 là
Đáp án C
Ba(HCO3)2 + 2HNO3 → Ba(NO3)2 + 2CO2↑ + 2H2O.
Ba(HCO3)2 + Ca(OH)2 → BaCO3↓ + CaCO3↓ + 2H2O.
Ba(HCO3)2 + 2KHSO4 → BaSO4↓ + K2SO4 + 2CO2↑ + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4↓ + 2NaHCO3.
Câu 27:
Trộn V lít dung dịch H2SO4 0,01M vào 2V lít dung dịch NaOH 0,025M. Gía trị pH của dung dịch thu được bằng
Đáp án A
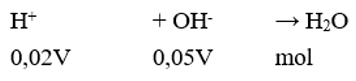
→ Sau phản ứng OH- dư;
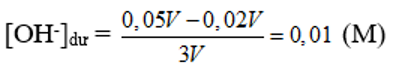
→ pOH = -log(0,01) = 2 →pH = 14 – pOH = 12.
Câu 28:
Nếu xem toàn bộ quá trình điều chế HNO3 có hiệu suất 80% thì từ 1mol NH3 sẽ thu được một lượng HNO3 là
Đáp án C
Ta có sơ đồ:
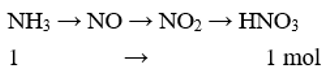
Do H = 80% nên số mol HNO3 thu được là: 1.80% = 0,8 (mol)
Khối lượng HNO3 thu được là: 0,8.63 = 50,4 gam.
Câu 29:
Cho các phản ứng của các dung dịch sau:
(1) Na2CO3 + H2SO4;
(2) Na2CO3 + FeCl3;
(3) Na2CO3 + CaCl2;
(4) NaHCO3 + Ba(OH)2;
(5) (NH4)2SO4 + Ba(OH)2;
(6) Na2S + AlCl3.
Số phản ứng mà sản phẩm có cả chất kết tủa và chất khí bay ra là
Đáp án C
(1) Na2CO3 + H2SO4 → Na2SO4 + CO2 ↑ + H2O
(2) 3Na2CO3 + 2FeCl3 + 3H2O → 6NaCl + 3CO2↑ + 2Fe(OH)3↓
(3) Na2CO3 + CaCl2 → 2NaCl + CaCO3 ↓
(4) 2NaHCO3 + Ba(OH)2 → BaCO3↓ + Na2CO3 + 2H2O
(5) (NH4)2SO4 + Ba(OH)2 → BaSO4 ↓ + 2NH3↑ + 2H2O.
(6) 3Na2S + 2AlCl3 + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Vậy các phản ứng (2); (5); (6) sản phẩm vừa có kết tủa, vừa có chất khí bay ra.