Đề thi Hóa 11 giữa kì 1 có đáp án (Đề 7)
-
1472 lượt thi
-
31 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Chất khi tan trong nước tạo thành dung dịch dẫn điện là:
Đáp án A
Muối ăn khi tan trong nước phân li thành các ion nên dung dịch muối ăn có khả năng dẫn điện:
NaCl → Na++ Cl-
Câu 2:
Trong các chất sau, chất nào là chất điện li yếu?
Đáp án B
Chất điện li yếu là: H2O.
Câu 3:
Câu nào dưới đây là đúng khi nói về sự điện li?
Đáp án C
Sự điện li là sự phân li một chất thành ion dương và ion âm khi chất đó tan trong nước hay ở trạng thái nóng chảy
Câu 4:
Phương trình điện li nào viết đúng
Đáp án B
Phương trình điện li đúng: KOH K+ + OH-
A sai vì NaCl là chất điện li mạnh.
C sai vì HClO là chất điện li yếu.
D sai vì Ca2+không phải Ca+.
Câu 5:
Cho các dung dịch axit: CH3COOH, HCl, H2SO4; HF đều có nồng độ là 0,1M. Độ dẫn điện của dung dịch nào tốt nhất:
Đáp án A
Dung dịch dẫn điện tốt nhất khi nồng độ các ion có trong dung dịch là lớn nhất.
Loại C và D vì là chất điện li yếu.
Chọn đáp án A vì nồng độ ion trong dung dịch lớn nhất.
HCl → H++ Cl-
0,1 0,1 0,1 M
H2SO4→ 2H++ SO42-
0,1 0,2 0,1 M
Câu 6:
Theo thuyết Arehinut, chất nào sau đây là axit?
Đáp án D
Theo thuyết Arehinut, axit là chất phân li ra H+
Suy ra CH3COOH là axit.
Câu 7:
Đối với dung dịch axit H2SO40,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng? (Coi như H2SO4phân li hoàn toàn ở cả 2 nấc)
Đáp án A
Phương trình điện li: H2SO4→ 2H++ SO42-
Nhìn vào phương trình ta thấy [H+] = 2[H2SO4] = 2.0,10 = 0,20M
Câu 8:
Nồng độ mol của anion NO3-trong dung dịch Ca(NO3)20,10M là
Đáp án B
Ca(NO3)2→ Ca2++ 2NO3-
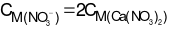 = 2.0,10 = 0,20M
= 2.0,10 = 0,20M
Câu 9:
Đặc điểm phân li Al(OH)3trong nước là
Đáp án B
Đặc điểm phân li Al(OH)3 trong nước là vừa theo kiểu axit vừa theo kiểu bazơ.
Phương trình điện li:
Theo kiểu bazơ: Al(OH)3 ⇆ Al3+ + 3OH-
Theo kiểu axit: Al(OH)3 ⇆ H+ + AlO2- + H2O
Câu 11:
Cho phản ứng có phương trình ion rút gọn là: H++ OH-→ H2O. Phản ứng xảy ra được vì:
Đáp án D
Phản ứng có phương trình ion rút gọn là: H++ OH-→ H2O. Phản ứng xảy ra được vì:
Sản phẩm sau phản ứng có chất điện li yếu là H2O
Câu 12:
Phản ứng hóa học sau: 2HNO3+ Ba(OH)2Ba(NO3)2+ 2H2O có phương trình ion rút gọn là
Đáp án D
2HNO3 + Ba2+ + 2OH- Ba(NO3)2 + 2H2O
Phương trình ion đầy đủ:
2H++ 2NO3-+ Ba2++ 2OH-→ Ba2++ 2NO3-+ 2H2O
Phương trình ion rút gọn của phản ứng trên là OH- + H+ → H2O
Câu 13:
Cặp dung dịch chất nào sau đây phản ứng với nhau tạo ra kết tủa?
Đáp án B
Phương trình phản ứng:
Na2CO3 + BaCl2 → 2NaCl + BaCO3↓
Câu 14:
Cho các dung dịch có cùng nồng độ: NaOH (1), H2SO4(2), HCl (3), KNO3(4). Giá trị pH của các dung dịch được sắp xếp theo chiều tăng dần từ trái sang phải là:
Đáp án D
Thứ tự tăng dần pH của các dung dịch có cùng nồng độ mol là:
H2SO4 (2)< HCl (3)< KNO3(4)< NaOH (1)
Câu 15:
Muối nào sau đây là muối axit?
Đáp án C
+ Muối axit là muối mà gốc axit còn H có khả năng phân li ra H+
+ Trong các muối đã cho, muối axit là: Ca(HCO3)2.
Ca(HCO3)2→ Ca2++ 2HCO3-
HCO3- H+ + CO32-
Câu 16:
Dung dịch nào dưới đây dùng để phân biệt dung dịch KCl với dung dịch K2CO3?
Đáp án A
HCl tác dụng với K2CO3, có khí bay ra; HCl không tác dụng với KCl.
Phương trình phản ứng:
K2CO3+ 2HCl → 2KCl + CO2↑ + H2O
Câu 17:
Trong phòng thí nghiệm, nitơ tinh khiết được điều chế bằng cách nào sau đây?
Đáp án D
Trong phòng thí nghiệm, nitơ được điều chế bằng cách nhiệt phân muối amoni nitrit NH4NO2.
Phương trình phản ứng: NH4NO2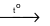 N2+ 2H2O
N2+ 2H2O
Câu 18:
Phân đạm cung cấp nguyên tố dinh dưỡng nào cần cho cây trồng:
Đáp án C
Phân đạm cung cấp nguyên tố dinh dưỡng cần cho cây trồng là: Nitơ.
Câu 19:
Cho khí NH3tác dụng với khí Cl2thấy có khói trắng. Khói trắng có công thức là:
Đáp án C
2NH3 + 3Cl2 → N2 + 6HCl
NH3 khí + HClkhí → NH4Cl (khói trắng)
Câu 20:
Cấu hình electron lớp ngoài cùng của các nguyên tố thuộc nhóm VA:
Đáp án B.
Cấu hình electron lớp ngoài cùng của các nguyên tố thuộc nhóm VA là: ns2np3
Câu 22:
Khí X gây hưng phấn hệ thần kinh có tính gây cười. Khí X là?
Đáp án C
Khí X gây hưng phấn hệ thần kinh có tính gây cười. Khí X là: N2O.
Câu 23:
HNO3không thể hiện tính oxi hoá mạnh khi tác dụng với chất nào?
Đáp án B
HNO3không thể hiện tính oxi hoá mạnh khi tác dụng với Fe2O3 vì không có sự thay đổi số oxi hóa của các nguyên tố trước và sau phản ứng.
Câu 24:
Phương trình phản ứng nào sau đây không thể hiện tính khử của NH3?
Đáp án A
Phương trình phản ứng không thể hiện tính khử của NH3là:
NH3+ HCl → NH4Cl.
Vì số oxi hóa của N không thay đổi sau phản ứng.
Câu 26:
Trong công nghiệp, người ta điều chế HNO3 từ NH3. Số lượng giai đoạn xảy ra trong quá trình điều chế là:
Đáp án C
Trong công nghiệp, người ta điều chế HNO3 từ NH3. Số lượng giai đoạn xảy ra trong quá trình điều chế là 3.
Giai đoạn 1: 4NH3 + 5O2 4NO + 6H2O
Giai đoạn 2: 2NO + O2 → 2NO2
Giai đoạn 3: 4NO2 + 2H2O + O2→ 4HNO3
Câu 27:
Khi có sấm chớp (Tia lửa điện), khí được sinh ra là:
Đáp án B
N2 + O2  2NO (khí nitơ monooxit)
2NO (khí nitơ monooxit)
Câu 28:
Cho phản ứng: Cu + HNO3→ Cu(NO3)2+ NO2+ H2O. Tổng hệ số của các chất trong phản ứng trên là.
Đáp án C
Phương trình phản ứng: Cu + 4HNO3→ Cu(NO3)2+ 2NO2+ 2H2O
Tổng hệ số của các chất trong phản ứng trên là: 1 + 4 + 1 + 2 + 2 = 10
Câu 29:
Viết phương trình điện li và phân loại các chất sau: NaOH, HClO, Na2SO4, Zn(OH)2
Phương trình điện li và phân loại:
- Bazơ: NaOH → Na++OH-
- Axit: HClOH++ ClO-
- Muối: Na2SO4→ 2Na++ SO42-
- Hiđroxit lưỡng tính: Zn(OH)2:
+ Sự phân li theo kiểu bazo: Zn(OH)2Zn2++ 2OH-
+ Sự phân li theo kiểu axit: Zn(OH)2 2H++ ZnO22-
Câu 30:
Dung dịch B chứa 0,2 mol Na+, 0,2 mol Cl-, x mol K+và y mol CO32-. Cô cạn B thì thu được 25,5 gam muối khan. Tìm giá trị của x và y?
Áp dụng định luật bảo toàn điện tích ta có: 0,2 + x = 0,2 + 2y suy ra x – 2y = 0 (1)
Có mmuối= 0,2.23 + 0,2. 35,5 + 39x + 60y = 25,5
Suy ra 39x + 60y = 13,8 (2)
Từ (1) và (2) suy ra x = 0,2 và y = 0,1
Câu 31:
Hoà tan hoàn toàn m gam nhôm trong dung dịch HNO3dư ta thu được 3,36 lít khí N2O là sản phẩm khử duy nhất ở (đktc). Tìm giá trị của m cần dùng.
Số mol của N2O là: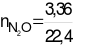 = 0,15 mol
= 0,15 mol
Phương trình phản ứng:

Suy ra m = mAl= 0,4.27 = 10,8 gam.
( Cho Al=27; Na=23;K=39; Cl=35,5; C=12;O=16;N=14)

 2KNO2 + O2
2KNO2 + O2