Đề thi Hóa 11 giữa kì 1 có đáp án (Đề 5)
-
1485 lượt thi
-
37 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
Phương trình ion rút gọn của phản ứng cho biết:
Đáp án B
Phương trình ion rút gọn của phản ứng cho biết: Bản chất của phản ứng trong dung dịch các chất điện li.
Câu 2:
Phản ứng Ba(OH)2+ Na2CO3có phương trình ion thu gọn là
Đáp án B
Ba(OH)2 + Na2CO3 → BaCO3↓ + 2NaOH
Phương trình ion đầy đủ:
Ba2+ + 2OH- + 2Na+ + CO32- → BaCO3↓ + 2Na+ + 2OH-
Phương trình ion thu gọn là: Ba2+ + CO32- → BaCO3
Câu 3:
Axit nitric để lâu trong không khí chuyển sang màu gì?
Đáp án A
Axit nitric kém bền, để lâu trong không khí có ánh sáng lâu ngày sẽ chuyển dần sang màu vàng là do axit HNO3 bị phân hủy một phần thành NO2 tan vào dung dịch làm cho axit có màu vàng.
4HNO3 → O2 + 2H2O + 4NO2↑ (màu nâu đỏ)
Câu 4:
Thể tích dd HCl 0,1 M cần để trung hoà 100 ml dd Ba(OH)20,1 M là
Đáp án D
= 0,1.0,1 = 0,01 mol
nOH- = 0,02 mol
Để trung hòa thì: nH+ = nOH- = 0,02 mol
VHCl = = 0,2 lít = 200 ml
Câu 5:
Ở điều kiện thường Nitơ tồn tại ở trạng thái nào?
Đáp án A
Ở điều kiện thường, nitơ là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí.
Câu 6:
Tính chất hóa học đặc trưng của HNO3là:
Đáp án C
HNO3 là một axit mạnh, có tính oxi hóa mạnh.
Câu 7:
Nung 7,58 gam Cu(NO3)2trong bình kín không chứa không khí, sau một thời gian thu được 4,88 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 500 ml dung dịch Y. Dung dịch Y có pH bằng.
Đáp án D
Gọi phản ứng là x mol
Phương trình phản ứng:
Bảo toàn khối lượng ta có: mchất rắn ban đầu = mchất rắn sau + mX
Suy ra 7,58 = 4,88 + 92x + 16x suy ra x = 0,025 mol
Hấp thụ X vào nước:
= 2x = 0,05 mol suy ra [H+] == 0,1M
Vậy dung dịch Y có pH = –log[H+] = 1
Câu 8:
Khi đốt khí NH3trong khí clo, khói trắng bay ra là
Đáp án A
2NH3 + 3Cl2 → N2 + 6HCl
NH3 + HCl → NH4Cl
Khói trắng chính là: NH4Cl
Câu 9:
Chất nào sau đây làm quỳ tím hóa xanh:
Đáp án B
+ Dung dịch có môi trường bazơ làm quỳ tím hóa xanh.
+ NaOH là bazơ nên làm quỳ tím hóa xanh.
Câu 10:
Một dung dịch có [H+] = 10-5M. Môi trường của dung dịch này là
Đáp án C
Có pH = -log[H+] = -log[10-5] = 5
Vậy môi trường của dung dịch này là axit.
Câu 11:
Theo thuyết điện li thì chất nào sao đây là axit?
Đáp án B
Theo areniut, axit là chất khi tan trong nước phân li ra H+.
Phương trình điện li của HNO3 là:
HNO3 → H+ + NO3-
Câu 12:
Trong các chất sau, chất nào không phải là chất điện li?
Đáp án đúng: D
C2H5OH không phải là chất điện li.
Loại A vì: KOH → K+ + OH-
Loại B vì: H2SO4 → 2H+ + SO42-
Loại C vì: NaHCO3 → Na+ + HCO3-
Câu 13:
Muối nào cho dưới đây là muối axit?
Đáp án C
+ Muối axit là muối mà trong gốc axit vẫn còn khả năng phân li ra H⁺
+ Muối axit là: NaHCO3.
NaHCO3 Na+ + HCO3-
Câu 14:
Dung dịch NH3làm phenolphtalein không màu chuyển thành màu gì?
Đáp án đúng: B
Dung dịch NH3 có môi trường kiềm, làm cho dung dịch phenolphthalein chuyển sang màu hồng.
Câu 15:
Phương trình ion Fe2+ + 2OH– Fe (OH)2 ứng với phương trình phân tử nào.
Đáp án A
Phương trình phản ứng:
FeCl2 + 2KOH Fe(OH)2 + 2KCl
Phương trình ion đầy đủ: Fe2+ + 2Cl- + 2K+ + 2OH- Fe(OH)2↓ + 2K+ + 2Cl-
Phương trình ion rút gọn: Fe2+ + 2OH– Fe (OH)2 ↓
Câu 16:
Thể tích khí N2(đktc) cần lấy để điều chế 1,7 gam NH3với H = 25% là:
Ta có:  = 0,1 mol
= 0,1 mol
Phương trình phản ứng:
N2+ 3H2 2NH3
2NH3
Vì hiệu suất H = 25%
Theo phương trình phản ứng ta có:  =
= 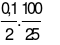 = 0,2 mol
= 0,2 mol
Vậy  = 0,2.22,4 = 4,48 lít.
= 0,2.22,4 = 4,48 lít.
Câu 17:
Thể tích khí N2(đktc) cần lấy để điều chế 1,7 gam NH3với H = 25% là:
Đáp án đúng: D
Ta có: = 0,1 mol
Phương trình phản ứng:
N2 + 3H2 2NH3
Vì hiệu suất H = 25%
Theo phương trình phản ứng ta có: = = 0,2 mol
Vậy = 0,2.22,4 = 4,48 lít.
Câu 18:
Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3loãng, dư thì thu được 0,448 lit khí NOduy nhất (đktc). Giá trị của m là.
Đáp án D
Số mol NO là: nNO= 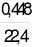 = 0,02 mol
= 0,02 mol 
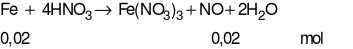
Suy ra nFe= 0,02 mol
Vậy mFe= 0,02.56 = 1,12 gam
Câu 19:
Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3loãng, dư thì thu được 0,448 lit khí NOduy nhất (đktc). Giá trị của m là.
Đáp án đúng: D
Số mol NO là: nNO = = 0,02 mol
Suy ra nFe = 0,02 mol
Vậy mFe = 0,02.56 = 1,12 gam
Câu 22:
Nồng độ mol của cation Ba2+trong dung dịch Ba(NO3)2 0,45M là
Đáp án A
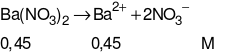
Suy ra [Ba2+] = 0,45M
Câu 23:
Nồng độ mol của cation Ba2+trong dung dịch Ba(NO3)20,45M là
Đáp án đúng: A
Suy ra [Ba2+] = 0,45M
Câu 24:
Để phân biệt các dung dịch mất nhãn H2SO4, KOH, NaNO3chỉ cần dùng thuốc thử duy nhất là:
Đáp án C
- Trích các mẫu thử.
- Cho quỳ tím lần lượt vào các mẫu thử chứa dung dịch H2SO4, KOH, NaNO3, nếu:
+ Qùy tím chuyển sang màu đỏ thì đó là H2SO4
+ Qùy tím chuyển sang màu xanh thì đó là KOH
+ Qùy tím không đổi màu thì đó là NaNO3
Câu 25:
Để phân biệt các dung dịch mất nhãn H2SO4, KOH, NaNO3chỉ cần dùng thuốc thử duy nhất là
Đáp án đúng: C
- Trích các mẫu thử.
- Cho quỳ tím lần lượt vào các mẫu thử chứa dung dịch H2SO4, KOH, NaNO3, nếu:
+ Qùy tím chuyển sang màu đỏ thì đó là H2SO4
+ Qùy tím chuyển sang màu xanh thì đó là KOH
+ Qùy tím không đổi màu thì đó là NaNO3
Câu 26:
Viết phương trình điện li các chất sau: HCl, NaOH, NH4Cl, CH3COOH.
Phương trình điện li:
HCl → H+ Cl-
NaOH → Na++ OH-
NH4Cl NH4+ + Cl-
CH3COOH CH3COO- + H+
Câu 27:
Viết phương trình điện li các chất sau: HCl, NaOH, NH4Cl, CH3COOH.
Phương trình điện li:
HCl → H++ Cl-
NaOH → Na++ OH-
NH4Cl → NH4++ Cl-
CH3COOH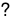 CH3COO-+ H+
CH3COO-+ H+
Câu 28:
Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có) xảy ra trong dung dịch:
- NaOH + HNO3
- FeSO4 + KOH
Phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch:
a. NaOH + HNO3→ NaNO3+ H2O
Phương trình ion rút gọn: H+ + OH- → H2O
b. FeSO4 + 2KOH → Fe(OH)2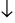 + K2SO4
+ K2SO4
Phương trình ion rút gọn: Fe2++ 2OH- → Fe(OH)2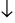
Câu 29:
Viết phương trình phân tử và ion rút gọn của các phản ứng sau (nếu có) xảy ra trong dung dịch.
Phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch:
a. NaOH + HNO3→ NaNO3+ H2O
Phương trình ion rút gọn: H++ OH-→ H2O
b. FeSO4+ 2KOH → Fe(OH)2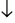 + K2SO4
+ K2SO4
Phương trình ion rút gọn: Fe2++ 2OH-→ Fe(OH)2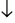
Câu 30:
Một dung dịch X chứa 0,1mol Fe2+; 0,2 mol Al3+; x mol Cl-và y mol SO42. Cô cạn dung dịch thu được 46,9g chất rắn khan. Tìm x và y.
Áp dụng định luật bảo toàn điện tích:

Suy ra: 2.0,1 + 3.0,2 = x + 2y
hay x + 2y = 0,8 (1)
Lại có:

Suy ra: 46,9 = 0,1.56 + 0,2.27 + x.35,5 + y.96
hay 35,5x + 96y = 35,9 (2)
Từ (1) và (2) suy ra x = 0,2; y = 0,3
Câu 31:
Một dung dịch X chứa 0,1mol Fe2+; 0,2 mol Al3+; x mol Cl-và y mol SO42-. Cô cạn dung dịch thu được 46,9g chất rắn khan. Tìm x và y.
Áp dụng định luật bảo toàn điện tích:

Suy ra: 2.0,1 + 3.0,2 = x + 2y
hay x + 2y = 0,8 (1)
Lại có:

Suy ra: 46,9 = 0,1.56 + 0,2.27 + x.35,5 + y.96
hay 35,5x + 96y = 35,9 (2)
Từ (1) và (2) suy ra x = 0,2; y = 0,3
Câu 32:
Viết PTHH thực hiện dãy sau: N2→ NO → NO2→ HNO3 → KNO3
Phương trình phản ứng:
(1) N2+ O2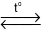 2NO
2NO
(2) 2NO + O2→ 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) HNO3+ KOH → KNO3+ H2O
Câu 33:
Viết PTHH thực hiện dãy sau: N2→ NO → NO2→ HNO3→ KNO3
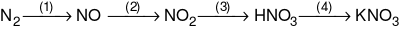
Phương trình phản ứng:
(1) N2+ O2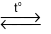 2NO
2NO
(2) 2NO + O2→ 2NO2
(3) 4NO2+ O2+ 2H2O → 4HNO3
(4) HNO3+ KOH → KNO3+ H2O
Câu 34:
Cho 17,6 gam hỗn hợp 2 kim loại Cu và Fe vào dung dịch HNO3đặc nóng, dư thu được 17,92 lit khí NO2(đktc) duy nhất. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu.
Số mol NO2là:  mol
mol 
Đặt x, y lần lượt là số mol của Cu và Fe
Ta có: 64x + 56y = 17,6 (1)
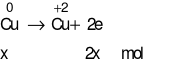


Có số e nhường = số e nhận
Suy ra 2x + 3y = 0,8 (2)
Từ (1) và (2) suy ra x = 0,1; y = 0,2
Khối lượng của Cu là: mCu= 0,1.64 = 6,4 gam
Suy ra phần trăm khối lượng Cu là: %Cu = 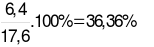
Suy ra phần trăm khối lượng của Fe là: %Fe = 100% - 36,36% = 63,64%
Câu 35:
Cho 17,6 gam hỗn hợp 2 kim loại Cu và Fe vào dung dịch HNO3đặc nóng, dư thu được 17,92 lit khí NO2(đktc) duy nhất.
Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp đầu.
Số mol NO2là: mol
mol
Đặt x, y lần lượt là số mol của Cu và Fe
Ta có: 64x + 56y = 17,6 (1)
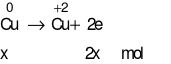
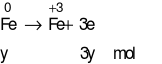

Có số e nhường = số e nhận
Suy ra 2x + 3y = 0,8 (2)
Từ (1) và (2) suy ra x = 0,1; y = 0,2
Khối lượng của Cu là: mCu= 0,1.64 = 6,4 gam
Suy ra phần trăm khối lượng Cu là: %Cu =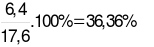
Suy ra phần trăm khối lượng của Fe là: %Fe = 100% - 36,36% = 63,64%
Câu 36:
Hoà tan 3,6 g Mg vào dung dịch HNO3loãng dư. Sau khi phản ứng xảy ra hoàn toàn thu được 0,224 lít N2(ở đktc). Cô cạn dung dịch thu được m g muối. Tính giá trị của m.
Số mol của Mg là: nMg =  = 0,15 mol
= 0,15 mol
Số mol của N2là:  = 0,01 mol
= 0,01 mol
Bảo toàn e ta có: 2nMg= 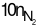 +
+ 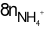 ⇒ 2.0,15 = 10.0,01 +
⇒ 2.0,15 = 10.0,01 + 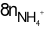
⇒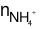 = 0,025 mol
= 0,025 mol
Vậy m = mmuối= 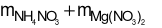 = 0,025.80 + 0,15.148 = 24,2 gam.
= 0,025.80 + 0,15.148 = 24,2 gam.
Câu 37:
Hoà tan 3,6 g Mg vào dung dịch HNO3loãng dư. Sau khi phản ứng xảy ra hoàn toàn thu được 0,224 lít N2(ở đktc). Cô cạn dung dịch thu được m g muối. Tính giá trị của m.
Số mol của Mg là: nMg= = 0,15 mol
= 0,15 mol
Số mol của N2là: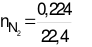 = 0,01 mol
= 0,01 mol
Bảo toàn e ta có: 2nMg=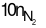 +
+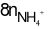 ⇒ 2.0,15 = 10.0,01 +
⇒ 2.0,15 = 10.0,01 +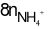
⇒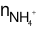 = 0,025 mol
= 0,025 mol
Vậy m = mmuối=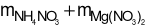 = 0,025.80 + 0,15.148 = 24,2 gam.
= 0,025.80 + 0,15.148 = 24,2 gam.
