Đề thi Hóa 11 giữa kì 1 có đáp án (Đề 8)
-
1474 lượt thi
-
31 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Dung dịch nào dưới đây có khả năng dẫn điện?
Đáp án B
+ Để dẫn điện thì trong dung dịch chất đó phải phân li ra ion.
+ Dung dịch có khả năng dẫn điện là: Dung dịch muối ăn.
NaCl → Na++ Cl-
Câu 2:
Chất nào sau đây là chất điện li mạnh?
Đáp án C
Các dung dịch kiềm như LiOH, KOH, Ba(OH)2, NaOH … đều là những chất điện li mạnh.
Câu 3:
Chọn phát biểu sai ?
Đáp án A
Phát biểu A sai vì nhiều chất như: C2H5OH; C6H12O6(đường glucozơ)… không điện li.
Câu 4:
Phương trình điện li nào viết đúng:
Đáp án D
Phương trình điện li viết đúng là: HClO H+ + ClO-
A và B sai vì NaCl; KOH là các chất điện li mạnh.
C sai vì Ca2+không phải Ca+.
Câu 5:
Các dung dịch sau đây có cùng nồng độ 0,10 mol/l, dung dịch nào dẫn điện kém nhất?
Đáp án B
Trong 4 chất chỉ có HF là chất điện li yếu. Vậy dung dịch HF dẫn điện kém nhất.
Câu 6:
Dung dịch chất nào sau đây làm xanh quỳ tím?
Đáp án C
+ Môi trường bazơ làm quỳ tím hóa xanh.
+ Dung dịch chất làm xanh quỳ tím là: NaOH.
Câu 7:
Đối với dung dịch axit yếu CH3COOH 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
Đáp án D
CH3COOH ⇄ CH3COO- + H+
Do CH3COOH là chất điện li yếu nên lượng CH3COOH phân li nhỏ hơn 0,1M.
Vậy ta có đánh giá đúng: [H+]< 0,1M
Câu 8:
Nồng độ mol của cation Ca2+trong dung dịch Ca(NO3)20,10M là
Đáp án A
Ca(NO3)2→ Ca2++ 2NO3-
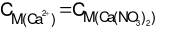 = 0,10M
= 0,10M
Câu 9:
Chất nào sau đây là hiđroxit lưỡng tính?
Đáp án D
Chất hiđroxit lưỡng tính là: Zn(OH)2
Phân li theo kiểu bazơ: Zn(OH)2→ Zn2++ 2OH-
Phân li theo kiểu axit: Zn(OH)2→ ZnO22-+ 2H+
Câu 11:
Hãy chọn câu trả lời đúng: Phản ứng trao đổi trong dung dịch các chất điện li chỉ có thể xảy ra khi có ít nhất một trong các điều kiện sau:
Đáp án D
Phản ứng trao đổi trong dung dịch các chất điện li chỉ có thể xảy ra khi có ít nhất một trong các điều kiện sau:
+ Tạo thành chất kết tủa.
+ Hoặc tạo thành chất khí.
+ Hoặc tạo thành chất điện li yếu. `
Câu 12:
Phản ứng hóa học nào dưới đây có phương trình ion thu gọn là: H++ OH-→ H2O
Đáp án A
HCl + NaOH → NaCl + H2O.
Phương trình ion thu gọn là: H++ OH-→ H2O
Câu 13:
Cặp dung dịch nào sau đây phản ứng với nhau tạo ra chất khí?
Đáp án B
Ba(OH)2+ 2NH4Cl → BaCl2+ 2NH3↑ + 2H2O
Câu 14:
Cho các dung dịch có cùng nồng độ mol: HNO3; NH3; NaCl; NaOH. Dãy gồm các chất trên được sắp xếp theo thứ thự tăng dần độ pH là
Đáp án C
HNO3: axit mạnh, NaCl: môi trường trung tính, NH3: bazơ yếu, NaOH: bazơ mạnh
Thứ thự tăng dần độ pH là: HNO3, NaCl; NH3; NaOH.
Câu 15:
Muối nào sau đây là muối axit?
Đáp án D
+ Muối axit là muối mà gốc axit còn H có khả năng phân li ra H+
+ Trong các muối đã cho, muối axit là: NaHCO3.
NaHCO3→ Na++ HCO3-.
HCO3- H+ + CO32-
Câu 16:
Dung dịch nào dưới đây dùng để phân biệt dung dịch KCl với dung dịch KNO3?
Đáp án A
Sử dụng dung dịch AgNO3:
+ KCl tác dụng với AgNO3tạo kết tủa trắng.
+ KNO3không phản ứng.
Phương trình phản ứng:
AgNO3+ KCl → AgCl↓ + KNO3
Câu 17:
Phương pháp chủ yếu sản xuất N2trong công nghiệp
Đáp án A
Phương pháp chủ yếu sản xuất N2trong công nghiệp: Chưng cất phân đoạn không khí lỏng.
Câu 18:
Nitơ phản ứng được với các chất nào sau đây để tạo hợp chất khí?
Đáp án C
Phương trình phản ứng:
N2+ O2→ 2NO
N2+ 3H22NH3
Câu 19:
Khí làm quì tím ẩm hóa xanh là:
Đáp án B
Khí làm quì tím ẩm hóa xanh là: Amoniac.
Vì dung dịch NH3tan trong nước có trong quỳ tím ẩm tạo môi trường bazơ.
Câu 20:
Số oxi hóa cao nhất của nitơ trong các hợp chất là:
Đáp án A
Số oxi hóa cao nhất của nitơ trong các hợp chất là: +5.
Câu 21:
Kim loại bị thụ động trong HNO3đặc nguội là:
Đáp án C
Kim loại bị thụ động trong HNO3đặc nguội là: Al, Fe.
Câu 22:
Ứng dụng nào không phải của HNO3?
Đáp án C
Ứng dụng của HNO3là: Sản xuất phân bón, sản xuất thuốc nổ, sản xuất thuốc nhuộm, dược phẩm, …
Câu 23:
Khi có sấm chớp, khí quyển sinh ra khí
Đáp án A
Khi có sấm chớp, khí quyển sinh ra khí NO.
Câu 24:
Trong các phản ứng sau, phản ứng nào NH3 đóng vai trò là chất khử?
Đáp án C
Phản ứng nào NH3 đóng vai trò là chất khử là: 4NH3 + 5O2 → 4NO + 6H2O
Vì số oxi hóa của N tăng từ -3 lên +2 sau phản ứng.
Câu 25:
Trong phòng thí nghiệm, người ta thường điều chế HNO3từ.
Đáp án D
Trong phòng thí nghiệm HNO3được điều chế từ NaNO3rắn và H2SO4đặc.
Phương trình phản ứng:
2NaNO3+ H2SO4(đặc) 2HNO3+ Na2SO4
2HNO3+ Na2SO4
Câu 26:
Sản phẩm của phản ứng nhiệt phân Cu(NO3)2:
Đáp án D
Phương trình phản ứng:
2Cu(NO3)2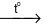 2CuO + 4NO2+ O2
2CuO + 4NO2+ O2
Câu 27:
Trong không khí. Khí nito chiếm bao nhiêu phần trăm không khí:
Đáp án B
Trong không khí, khí nito chiếm khoảng 78%.
Câu 28:
Cho phản ứng: Al + HNO3→ Al(NO3)3+ NO2+ H2O. Tổng hệ số của các chất trong phản ứng trên là.
Đáp án C
Al + 6HNO3→ Al(NO3)3+ 3NO2+ 3H2O
Tổng hệ số của các chất trong phản ứng trên là: 1 + 6 + 1 + 3 + 3 = 14.
Câu 29:
Viết phương trình điện li và phân loại các chất sau: NaOH, HClO, Na2SO4, Zn(OH)2. (1 điểm)
Phương trình điện li và phân loại:
- Bazơ: NaOH → Na++OH-
- Axit: HClO ⇄ H++ ClO-
- Muối: Na2SO4→ 2Na++ SO42-
- Hiđroxit lưỡng tính: Zn(OH)2:
+ Sự phân li theo kiểu bazơ: Zn(OH)2⇄ Zn2++ 2OH-
+ Sự phân li theo kiểu axit: Zn(OH)2⇄ 2H++ ZnO22-
Câu 30:
Dung dịch B chứa 0,2 mol Na+, 0,2 mol Cl-, x mol K+và y mol CO32-. Cô cạn B thì thu được 25,5 gam muối khan. Tìm giá trị của x và y? (1 điểm)
Áp dụng định luật bảo toàn điện tích ta có: 0,2 + x = 0,2 + 2y suy ra x – 2y = 0 (1)
Có mmuối= 0,2.23 + 0,2. 35,5 + 39x + 60y = 25,5
Suy ra 39x + 60y = 13,8 (2)
Từ (1) và (2) suy ra x = 0,2 và y = 0,1
Câu 31:
Hoà tan hoàn toàn m gam nhôm trong dung dịch HNO3dư ta thu được 3,36 lít khí N2O là sản phẩm khử duy nhất ở (đktc). Tìm giá trị của m cần dùng. (1 điểm)
Số mol của N2O là: = 0,15 mol
= 0,15 mol
Phương trình phản ứng:

Suy ra m = mAl= 0,4.27 = 10,8 gam.
(Cho Al=27; Na=23;K=39; Cl=35,5; C=12;O=16;N=14)
