Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 9)
-
4665 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
Các nguyên tố nhóm halogen thuộc nhóm VIIA trong bảng tuần hoàn.
Câu 2:
Chọn đáp án A
Phương pháp giải:
Tính độ bất bão hòa của C4H10 ta thấy = 0 → thuộc hiđrocacbon no
→ Có đồng phân về mạch cacbon (mạch thẳng và mạch nhánh)
Giải chi tiết:
C4H10 có 2 CTCT là:
CH3 - CH2 - CH2 - CH3
CH3 - CH(CH3) - CH3
Câu 3:
Chất nào dưới đây vừa tác dụng với dung dịch NaOH vừa tác dụng với dung dịch HCl ?
Chọn đáp án B
Phương pháp giải:
Dựa vào kiến thức đã học về tính chất hóa học của các chất đã cho → chọn chất thỏa mãn.
Giải chi tiết:
Al(OH)3 là hidroxit lưỡng tính nên vừa tác dụng được với dd NaOH và dd HCl
PTHH minh họa: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Câu 4:
Chọn đáp án A
Phương pháp giải:
Đun nóng dd thu được lại thấy xuất hiện kết tủa → CO2 hấp thụ vào dd Ca(OH)2 tạo 2 muối
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
CO2 + 2Ca(OH)2 → Ca(HCO3)2 (2)
Đổi số mol các chất và tính toán theo 2 PTHH trên
Giải chi tiết:
Đun nóng dd thu được lại thấy xuất hiện kết tủa → CO2 hấp thụ vào dd Ca(OH)2 tạo 2 muối
PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1)
CO2 + 2Ca(OH)2 → Ca(HCO3)2 (2)
nCa(OH)2 = 4.0,01 = 0,04 (mol)
nCaCO3 = 1 : 100 = 0,01 (mol)
Theo PTHH (1): nCO2(1) = nCa(OH)2 (1) = nCaCO3 = 0,01 (mol)
→ nCa(OH)2 (2) = ∑ nCa(OH)2 - nCa(OH)2 (1) = 0,04 - 0,01 = 0,03 (mol)
Theo PTHH (2): nCO2(2) = 2nCa(OH)2 (2) = 2.0,03 = 0,06 (mol)
→ ∑ nCO2(1)+(2) = 0,01 + 0,06 = 0,07 (mol)
→ VCO2(đktc) = 0,07×22,4 = 1,568 (lít)
Câu 5:
Chọn đáp án A
Phương pháp giải:
Đặt công thức phân tử của metylơgenol là CxHyOz (đk: x, y,z nguyên dương)
Ta có:
→ Công thức đơn giản nhất = ?
Có M = 178 g/mol và công thức đơn giản nhất ta dễ dàng tìm được CTPT
áp dụng công thức tính số liên kết pi + vòng sẽ ra được đáp án
Giải chi tiết:
%O = 100% - %C - %H = 100% - 74,16% - 7,86% = 17,98%
Đặt công thức phân tử của metylơgenol là CxHyOz (đk: x, y,z nguyên dương)
Ta có:
Công thức đơn giản nhất: C11H14O2
Vì M = 178 g/mol →
Vậy CTPT của metylơgenol là C11H14O2
Tổng số liên kết pi + vòng là:
Câu 6:
Chọn đáp án A
Phương pháp giải:
Dựa vào tính chất hóa học của P trong sgk hóa 11
Giải chi tiết:
2P + 3Mg Mg3P2
Câu 7:
Cho các phát biểu sau:
a) Cho Cu vào HNO3 đặc sinh ra khí NO2 màu nâu đỏ.
b) Đưa than đỏ vào KNO3 nóng chảy sinh ra khí CO2 làm đục nước vôi trong
c) Cho dung dịch CaCl2 vào dung dịch Na2CO3 xuất hiện kết tủa trắng
d) Cho dung dịch NaOH vào dung dịch (NH4)2SO4, đun nhẹ có khí thoát ra làm quỳ tím ẩm hóa xanh.
Số phát biểu đúng là
Chọn đáp án B
Phương pháp giải:
Dựa vào kiến thức lí thuyết tổng hợp về Cacbon và Nitơ
Giải chi tiết:
(a) đúng, PTHH minh họa: Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2↑ + 2H2O
(b) đúng, PTHH minh họa: C + 4KNO3 CO2 + 4NO2 + 2K2O
CO2 + Ca(OH)2 → CaCO3↓(trắng) + H2O
(c) đúng, PTHH minh họa: CaCl2 + Na2CO3 → CaCO3↓ (trắng) + 2NaCl
(d) đúng, PTHH minh họa: 2NaOH + (NH4)2SO4 Na2SO4 + 2NH3↑ + 2H2O
Khí NH3 thoát ra làm xanh quỳ tím ẩm
→ cả 4 phát biểu đúng
Câu 8:
Chọn đáp án B
Phương pháp giải:
Dựa vào kiến thức về phản ứng nhiệt phân của muối amoni
Giải chi tiết:
Sai sửa lại: NH4NO3 N2O + 2H2O
Câu 9:
Chọn đáp án B
Phương pháp giải:
Chất điện li là chất tan trong nước phân li ra các ion
Giải chi tiết:
Axit clohiđric (HCl) là chất điện li vì chất này tan trong nước phân li ra các ion như sau:
HCl → H+ + Cl-
Câu 10:
Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohi đric.
- Nhóm thứ nhất: Cân miếng kẽm 1 gam và thả vào cốc đựng 200 ml dung dịch axit HCl 2M.
- Nhóm thứ hai: Cân 1 gam bột kẽm và thả vào cốc đựng 300 ml dung dịch axit HCl 2M
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
Chọn đáp án C
Phương pháp giải:
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, nhiệt độ, diện tích tiếp xúc bề mặt
Giải chi tiết:
Bột kẽm có diện tích tiếp xúc với HCl lớn hơn miếng kẽm nên khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn của nhóm thứ nhất
Câu 11:
Chọn đáp án A
Phương pháp giải:
Áp dụng công thức tính hằng số cân bằng: với [NH3]; [N2]; [H2] là nồng độ mol/l của các chất đó ở trạng thái cân bằng.
Giải chi tiết:
N2 (k) + 3H2 (k) ⇄ 2NH3 (k).
Áp dụng công thức tính hằng số cân bằng:
Câu 12:
Cho hình vẽ mô tả quá trình định tính các nguyên tố C và H trong hợp chất hữu cơ. Vai trò của CuSO4 (khan) và sự biến đổi màu của nó trong thí nghiệm là
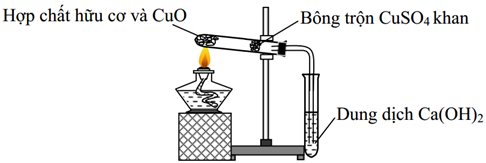
Chọn đáp án D
Phương pháp giải:
Dựa vào kĩ năng quan sát hình vẽ thí nghiệm.
CuSO4 rắn khan có màu trắng còn khi ở trạng thái dd sẽ có màu xanh.
Giải chi tiết:
CuSO4 (khan) có vai trò định tính nguyên tố H. Vì CuSO4(khan) gặp H2O sẽ chuyển sang dd CuSO4.5H2O có màu xanh→ từ việc xác định có mặt H2O → suy được chất hữu cơ ban đầu có H
Câu 13:
Chọn đáp án D
Phương pháp giải:
Đặt công thức chung của 2 muối NaX, NaY là
PTHH:
Dùng phương pháp tăng giảm khối lượng
Giải chi tiết:
Đặt công thức chung của 2 muối NaX, NaY là
PTHH:
(mol) a → a
→ mtăng =
Theo đề bài: mtăng = 57,34 - 31,84 = 25,5 (g)
→ 85a = 25,5
→ a = 0,3
Vì X, Y là 2 halogen ở 2 chu kì liên tiếp nên
→ Công thức 2 muối: NaBr và NaI
Câu 14:
Chọn đáp án A
Phương pháp giải:
Dung dịch có pH nhỏ nhất tức có nồng độ H+ lớn nhất → chất phân li cho H+ nhiều nhất
Giải chi tiết:
Dung dịch có pH nhỏ nhất tức có nồng độ H+ lớn nhất → chất phân li cho H+ nhiều nhất → HNO3
Câu 15:
Chọn đáp án B
Phương pháp giải:
mbình 1 tăng = mH2O → nH = 2nH2O = ? (mol)
BTNT “C”: nCO2 = nCaCO3 → nC = nCO2 = ? (mol)
BTKL có: mO(Y) = mY - mC - mH = ? (g) → nO(Y) = ?(mol)
Đặt công thức phân tử của X : CxHyOz (đk: x,y,z nguyên dương)
Ta có: x: y : z = nC : nH : nO = ?
Kết hợp với đáp án → CTPT thỏa mãn
Giải chi tiết:
mbình 1 tăng = mH2O = 3,6 (g) → nH2O = 3,6 : 18 = 0,2 (mol) → nH = 2nH2O = 2.0,2 = 0,4 (mol)
BTNT “C”: nCO2 = nCaCO3 = 30 : 100 = 0,3 (mol) → nC = nCO2 = 0,3 (mol)
BTKL có: mO(Y) = mY - mC - mH = 10,4 - 0,3.12 - 0,4.1 = 6,4 (g)
→ nO(Y) = 6,4 : 16 = 0,4 (mol)
Đặt công thức phân tử của X : CxHyOz (đk: x,y,z nguyên dương)
Ta có: x: y : z = nC : nH : nO = 0,3 : 0,4 : 0,4
= 3:4 :4
→ CTPT Y có dạng: (C3H4O4)n
Kết hợp với đáp án → n = 1 thỏa mãn → CTPT Y: C3H4O4
Câu 16:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
PTHH: 2Fe + 3Cl2 dư 2FeCl3
→ Muối thu được là FeCl3
Câu 17:
Chọn đáp án D
Phương pháp giải:
Lý thuyết về phân bón hóa học.
Giải chi tiết:
Độ dinh dưỡng của phân kaki được đánh giá bằng hàm lượng phần trăm K2O về khối lượng.
Câu 18:
Chọn đáp án A
Phương pháp giải:
Dựa vào kiến thức điều chế CH4 trong sgk hóa 11 - trang 114
Giải chi tiết:
PTHH điều chế CH4 trong PTN: CH3COONa + NaOH CH4↑ + Na2CO3
Câu 19:
Chọn đáp án C
Phương pháp giải:
Đổi số mol SO2 và NaOH
PTHH: SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Lập tỉ lệ:
Nếu k ≤ 1 phản ứng chỉ tạo muối NaHSO3. Tính toán theo số mol NaOH
Nếu k ≥ 2 phản ứng chỉ tạo muối Na2SO3. Tính toán theo số mol SO2
Nếu 1 < k < 2 phản ứng tạo cả NaHSO3 và Na2SO3. Đặt số mol mỗi muối, lập hệ 2 ẩn 2 phương trình với số mol SO2 và NaOH sẽ giải ra được số mol mỗi muối
Giải chi tiết:
Ta có:
Ta thấy: 1 < 1,25 < 2. Do vậy SO2 pư với dd NaOH tạo 2 muối. Cả SO2 và NaOH đều phản ứng hết.
PTHH: SO2 + NaOH → NaHSO3
(mol) x x ← x
SO2 + 2NaOH → Na2SO3 + H2O
(mol) y 2y ← y
Ta có hệ phương trình:
Câu 20:
Chọn đáp án B
Phương pháp giải:
Dựa vào kiến thức về Silic trong sgk hóa 11 - trang 76
Giải chi tiết:
Si (Z = 14): 1s22s22p63s23p2
Câu 21:
Chọn đáp án C
Phương pháp giải:
X ít hơn X3- 3e. Từ đó viết được cấu hình của X bằng cách bỏ đi 3e lớp ngoài cùng của X3-
Giải chi tiết:
X + 3e → X3-
→ X ít hơn X3- 3e
→ Cấu hình của X là: 1s22s22p63s23p3
→ X có 15e, có 3 lớp e, có 5e lớp ngoài cùng và e cuối cùng điền vào phân lớp p
→ X thuộc ô thứ 15, chu kì 3, nhóm VA trong BTH
Câu 22:
Chọn đáp án B
Phương pháp giải:
Xác định sự thay đổi số oxi hóa của các nguyên tố trong H2S.
Nếu số oxi hóa tăng sau phản ứng thì H2S đóng vai trò chất khử
Nếu số oxi hóa giảm sau phản ứng thì H2S đóng vai trò chất oxi hóa
Nếu số oxi hóa cả tăng cả giảm thì H2S đóng vai trò cả chất khử và chất oxi hóa
Giải chi tiết:
S trong H2S có số oxi hóa tăng sau phản ứng → H2S đóng vai trò là chất khử
Câu 23:
Chọn đáp án C
Phương pháp giải:
1 liên kết đơn = 1 liên kết xích ma
1 liên kết đôi = 1 liên kết xích ma + 1 liên kết pi
Giải chi tiết:
CH2=CH2 có 5 liên kết xích ma trong phân tử (gồm 4 liên kết xích ma của 4 liên kết đơn C-H và 1 liên kết xích ma trong liên kết đôi C=C)
Câu 24:
Chọn đáp án A
Phương pháp giải:
Dựa vào khái niệm chất hữu cơ: là hợp chất của cacbon trừ CO,CO2, muối cacbonat, muối cacbua kim loại, HCN, muối xianua…
Giải chi tiết:
A. thỏa mãn
B. Loại NaHCO3
C. Loại CO2, CO
D. Loại NaCN, SiO2
Câu 25:
Chọn đáp án C
Phương pháp giải:
NH3 + 3CuO 3Cu + N2 + 3H2O
Giải chi tiết:
Phản ứng mà số oxi hóa của N trong NH3 không tăng sau phản ứng thì NH3 không đóng vai trò chất khử
Ta thấy phản ứng ở đán án C NH3 không có sự thay đổi số oxi hóa trước và sau phản ứng → không đóng vai trò là chất khử.
Các phản ứng còn lại số oxi hóa của N trong NH3 đều tăng sau phản ứng nên NH3 đóng vai trò là chất khử
Câu 26:
Chọn đáp án D
Phương pháp giải:
Dựa vào kiến thức lí thuyết về nitơ và hợp chất của nó trong sgk hóa 11
Giải chi tiết:
NO và O2 phản ứng được với nhau ở đk thường
PTHH: 2NO + O2 → 2NO2 (màu nâu đỏ)
Câu 27:
Chọn đáp án C
Phương pháp giải:
Giải chi tiết:
Khí X là H2S; khí Y là SO2
PTHH:
Câu 28:
Chọn đáp án B
Phương pháp giải:
Dựa vào kiến thức về cacbon trong sgk hóa 11 - trang 66
Giải chi tiết:
Các số oxi hóa thường gặp của Cacbon: -4, 0, +2, +4.
Câu 29:
Chọn đáp án B
Phương pháp giải:
Viết đồng phân về mạch cacbon và vị trí của Cl
Giải chi tiết:
Các CTCT mạch hở của CTPT C3H6Cl2
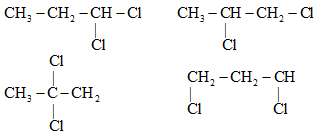
→ có 4 CTCT
Câu 30:
Chọn đáp án C
Phương pháp giải:
CO chỉ khử được các oxit kim loại sau Al trong dãy điện hóa
Giải chi tiết:
Câu 31:
Chọn đáp án B
Phương pháp giải:
Dựa vào kiến thức về nguyên tử trong sgk hóa 10
Giải chi tiết:
Hạt nhân được cấu tạo bởi proton và nơtron
Câu 32:
Chọn đáp án D
Phương pháp giải:
Cân bằng phương trình theo phương pháp thăng bằng electron
Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố, xác định chất khử, chất oxi hóa.
Bước 2: Viết quá trình oxi hóa, quá trình khử, cân bằng mỗi quá trình.
Bước 3: Đặt hệ số thích hợp trước chất khử, chất oxi hóa sao cho số electron quá trình oxi hóa bằng số electron quá trình khử.
Bước 4: Đặt hệ số thích hợp vào các chất trong phương trình và hoàn thành phương trình.
Giải chi tiết:
Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố trong phản ứng
Bước 2,3: Viết quá trình oxi hóa, quá trình khử, cân bằng mỗi quá trình. Đặt hệ số trước chất khử, chất oxi hóa thích hợp sao cho số mol e nhường quá trình oxi hóa = số mol e nhận của quá trình khử
Bước 3: Đặt hệ số vào chất khử, chất oxi hóa. Cân bằng phương trình
Kiểm tra nguyên tố N bên vế phải sau đó đặt hệ số HNO3 bên vế trái
Sau đó kiểm tra số H bên vế trái và đặt vào hệ số H2O bên vế phải
Kiểm tra cả 2 vế oxi đều đủ 12 nguyên tử O → phương trình trên được cân bằng
Vậy (a+b) = (1+4) = 5
Câu 33:
Chọn đáp án C
Phương pháp giải:
Viết pt ion rút gọn các quá trình xảy ra
Sử dụng bảo toàn điện tích với các chất trong dd X
Giải chi tiết:
Đặt trong 1/2 dd X
Xét dd X + NaOH dư thu được 2 gam kết tủa, còn khi pư với dd Ca(OH)2 dư cho 3 gam kết tủa
→ Chứng tỏ lượng kết tủa 2 gam tính theo số mol của Ca2+ ban đầu.
Lượng kết tủa 3g tính theo số mol của HCO3-
HCO3- + OH- → CO32- + H2O
CO32- + Ca2+ → CaCO3↓
nCaCO3 = 2 : 100 = 0,02 (mol) → nCa2+ bđ = nCaCO3 = 0,02 (mol) → a = 0,02
nCaCO3 = 3 : 100 = 0,03 (mol) → nHCO3- bđ = nCaCO3 = 0,03 (mol) → b = 0,03
Bảo toàn điện tích với các chất trong dd X ta có:
Đun sôi 1/2 dd X có phản ứng:
2HCO3- → CO32- + CO2↑ + H2O
0,03 → 0,015 (mol)
Rắn thu được chứa các ion là: Ca2+: 0,02 (mol); Na+: 0,04 (mol); CO32-:0,015 (mol); Cl-: 0,05 (mol)
→ mrắn = 0,02.40 + 0,04.23 + 0,015.60 + 0,05.35,5 = 4,395 (g)
Vậy đun sôi toàn bộ X thu được mrắn = 2×4,395=8,79 (g)
Câu 34:
Chọn đáp án C
Phương pháp giải:
Coi hh X gồm Fe, Cu và S
Sử dụng bảo toàn nguyên tố S, H
Sử dụng bảo toàn khối lượng và bảo toàn e
Giải chi tiết:
Coi hh X gồm Fe, Cu và S
BTNT “S”: nS = nBaSO4 = 4,66 : 233 = 0,02 (mol)
quá trình nhường e
Fe → Fe+3 + 3e
x → 3x (mol)
Cu → Cu+2 + 2e
y → 2y (mol)
S + H2O + 6e → 8H+ + SO42-
0,02 → 0,12→ 0,16 (mol)
quá trình nhận e
4H+ + NO3‑ + 3e → NO + 2H2O (*)
0,28 0,21 ← 0,07 (mol)
Lượng H+ có trong dd Y là: nH+ = nHNO3 + 8nS - 4nNO = 0,5 + 8.0,02 - 4.0,07 = 0,38 (mol)
Ta có hệ:
Vậy dd Y chứa
Cho Cu vào dd Y có: nNO = 1/4nH+ = 1/4.0,38 = 0,095 (mol) (Nhìn theo tương tự như bán phản ứng (*))
Bảo toàn e ta có: 2nCu = nFe3+ + 3nNO = 0,02 + 3.0,095 → nCu = 0,1525 (mol)
→ mCu = 0,1525×64 = 9,76 (g)
Câu 35:
Chọn đáp án D
Phương pháp giải:
Dựa vào trạng thái tồn tại trong tự nhiên của photpho sgk hóa 11 - trang 48
Giải chi tiết:
Trong tự nhiên, photpho tồn tại ở dạng quặng photphorit (Ca3(PO4)2) và apatit (3Ca3(PO4)2.CaF2)
Câu 36:
Chọn đáp án C
Phương pháp giải:
Các chất dẫn được điện khi có các ion chuyển động có khả năng dẫn điện
Giải chi tiết:
KCl rắn, khan không dẫn được điện
Câu 37:
Chọn cách phát biểu đúng nhất trong các câu sau đây?
Đồng phân là những chất
Chọn đáp án A
Phương pháp giải:
Dựa vào khái niệm đồng phân trong sgk hóa 11
Giải chi tiết:
Đồng phân là những chất có cùng công thức phân tử nhưng khác nhau về công thức cấu tạo
Câu 38:
Chọn đáp án D
Phương pháp giải:
Dựa vào kết luận về nguyên nhân tính dẫn điện của các dd axit, bazơ và muối sgk hóa 11.
Giải chi tiết:
Các dung dịch axit, bazơ và muối dẫn điện được là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là ion
Câu 39:
Chọn đáp án D
Phương pháp giải:
Tìm được số mol mỗi khí N2 và H2.
Khí sinh ra có H2 → NO3- phải phản ứng hết.
Dung dịch muối thu được chứa MgCl2; KCl có thể có NH4Cl
Sử dụng bảo toàn e tìm được mol NH4Cl
Sử dụng BTNT N và K tìm được mol KCl
→ m = mMgCl2 + mNH4Cl + mKCl = ?
Giải chi tiết:
Tóm tắt:
Đặt
Sau phản ứng thu được H2 nên NO3- phản ứng hết.
quá trình nhường e
Mg → Mg+2 + 2e
0,145 → 0,29 (mol)
quá trình nhận e
2NO3- + 12H+ + 10e → N2 + 6H2O
0,2 ← 0,02 (mol)
NO3- + 10H+ + 8e → NH4+ + 3H2O
8a ← a (mol)
2H+ +2e → H2
0,01← 0,005 (mol)
Bảo toàn e ta có: ∑ne nhường = ∑ne nhận
→ 0,29 = 0,2 + 8a + 0,01
→ a = 0,01
→ nNH4Cl = 0,01 (mol)
BTNT “N”: nKNO3 = nNH4Cl + 2nN2 = 0,01 + 2.0,02 = 0,05 (mol)
BTNT “K”: nKCl = nKNO3 = 0,05 (mol)
Vậy dd X chứa muối gồm MgCl2: 0,145 (mol) và NH4Cl: 0,01 (mol) ; KCl: 0,05 (mol)
→ m = mMgCl2 + mNH4Cl + mKCl = 0,145.95 + 0,01.53,5 + 0,05.74,5 = 18,035 (g)
Câu 40:
Chọn đáp án A
Phương pháp giải:
Cân bằng phương pháp ion - electron
Áp dụng cho các phản ứng oxi hóa - khử xảy ra trong dd có sự tham gia của môi trường: axit, bazo, nước. Khi cân bằng sử dụng theo 4 bước như phương pháp thăng bằng electron nhưng chất oxi hóa, chất khử được viết đúng dạng mà nó tồn tại trong dd theo nguyên tắc sau:
1. Nếu phản ứng có axit tham gia:
+ Vế nào thiếu bao nhiêu O thêm bấy nhiêu H2O để tạo ra H+ ở vế kia và ngược lại
VD: NO3‑ → NO
Ta thấy vế phải thiếu 2O, thêm vế phải 2H2O để tạo vế trái 4H+, sau đó cân bằng điện tích của bán phản ứng
NO3‑ + 4H+ + 3e → NO + 2H2O
2. Nếu phản ứng có bazơ tham gia:
+ Vế nào thiếu bao nhiêu O thêm lượng OH- gấp đôi để tạo H2O ở vế kia và ngược lại
VD: Cr2O3 → 2CrO4-
Vế trái thiếu 5O thêm vế trái 10OH- để tạo 5H2O ở vế phải, sau đó cân bằng điện tích bán phản ứng
Cr2O3 + 10OH- → 2CrO4- + 5H2O +6e
3. Nếu phản ứng có H2O tham gia
+ Sản phẩm phản ứng tạo ra axit, cân bằng theo nguyên tắc 1
+ Sản phẩm phản ứng tạo ra bazơ, cân bằng theo nguyên tắc 2
MnO4- + 2H2O + 3e → MnO2 + 4OH-
Giải chi tiết:
Bước 1: Xác định sự thay đổi số oxi hóa của 1 số nguyên tố, xác định được chất khử, chất oxi hóa
Bước 2: Viết quá trình khử, quá trình oxi hóa, cân bằng mỗi quá trình và đặt hệ số thích hợp trước chất khử, chất oxi hóa
Bước 3: Viết bán phản ứng, ép đúng tỉ lệ Fe(OH)3 và nhân hệ số thích hợp để triệt tiêu OH-
Ta thấy trong phương trình phân tử Fe+3 tồn tại ở dạng Fe2(SO4)3 nên ta nhân cả 2 vê (3) với hệ số 2 để làm chẵn số nguyên tố Fe+3
Thêm ion K+, SO42- vào phương trình ion (4) ta được phương trình phân tử ban đầu cân bằng.
→ 18FeSO4 + 6KMnO4 + 12H2O → 3K2SO4 + 6MnO2 + 8Fe(OH)3 + 5Fe2(SO4)3
Vậy hệ số của H2O là 12
