Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 11)
-
4713 lượt thi
-
25 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án C
Phương pháp giải:
Tính theo PT ion rút gọn: PT: OH- + H+ → H2O
Giải chi tiết:
nOH- = nNaOH = 0,3.0,05 = 0,015 mol
nH+ = 2nH2SO4 = 2.0,2.0,05 = 0,02 mol
PT: OH- + H+ → H2O
Đb: 0,015 0,02 (mol)
Pư: 0,015 → 0,015 (mol)
Sau: 0 0,005 (mol)
=> [H+] = n : V = 0,005 : (0,3 + 0,2) = 0,01M
=> pH = -log[H+] = -log(0,01) = 2
Câu 2:
Chọn đáp án A
Phương trình ion thu gọn H+ + OH- → H2O biểu diễn bản chất của phản ứng: HCl + NaOH → NaCl + H2O
Câu 3:
Chọn đáp án A
Phương pháp giải:
1 gam X chứa 5/29 gam H
=> 58 gam X chứa 10 gam H
Giải chi tiết:
1 gam X chứa 5/29 gam H
=> 58 gam X chứa 10 gam H
=> nH = mH : MH = 10 : 1 = 10
=> Số nguyên tử H trong 1 phân tử X là 10
Câu 4:
Chọn đáp án A
Phương pháp giải:
Bảo toàn nguyên tố C.
Giải chi tiết:
Bảo toàn nguyên tố C ta có: nCO2 thu được = nCO + nCO2 bđ
Hay V CO2 thu được = VCO + VCO2 bđ = 1 lít
Câu 5:
Chọn đáp án A
Phương pháp giải:
Giả sử 1 mol hỗn hợp khí có chứa x mol CO2 và y mol N2.
+ n hh = x + y = 1 (1)
+ m hh = 44x + 28y = 18.2 = 36 (2)
Giải (1) và (2) được x, y
Từ đó tính được phần trăm về khối lượng mỗi khí trong hỗn hợp
Giải chi tiết:
Giả sử 1 mol hỗn hợp khí có chứa x mol CO2 và y mol N2.
+ n hh = x + y = 1 (1)
+ m hh = 44x + 28y = 18.2 = 36 (2)
Giải (1) và (2) được x = 0,5 mol và y = 0,5 mol
=> %mCO2 = (0,5.44/36).100% = 61,11% và %mN2 = (0,5.28/36).100% = 38,89%
Câu 6:
Chọn đáp án C
Phương pháp giải:
Giải chi tiết:
A loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với Fe(OH)2 và FeO
B loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với FeCO3
C đúng
D loại vì HNO3 còn thể hiện tính oxi hóa khi tác dụng với FeS
Câu 7:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
Than hoạt tính có khả năng hấp phụ cao nên để đề phòng nhiễm độc CO người ta sử dụng mặt nạ than hoạt tính.
Câu 8:
Chọn đáp án A
Phương pháp giải:
Tính tỉ lệ
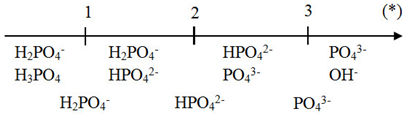
Qua sơ đồ ta thấy:
(*) ≤ 1 => tạo muối H2PO4-
1 < (*) < 2 => tạo muối H2PO4- và HPO42-
(*) = 2 => tạo muối HPO42-
2 < (*) < (3) => tạo muối HPO42- và PO43-
(*) ≤ 3 => tạo muối PO43-
Giải chi tiết:
nOH- = nKOH = 0,1 mol
nH3PO4 = 0,05 mol
=> nOH-/nH3PO4 = 0,1/0,05 = 2
=> Tạo muối K2HPO4
2KOH + H3PO4 → K2HPO4 + 2H2O
0,1 → 0,05 (mol)
=> CM K2HPO4 = 0,05 : (0,1 + 0,05) = 0,33M
Câu 9:
Cho các axit sau:
(1) H3PO4 (Ka = 7,6.10-3)
(2) HOCl (Ka = 5.10-8)
(3) CH3COOH (Ka = 1,8.10-5)
(4) H2SO4 (Ka = 10-2)
Dãy nào sắp xếp độ mạnh của các axit theo thứ tự tăng dần?
Chọn đáp án C
Phương pháp giải:
Ka càng lớn tính axit càng mạnh.
Giải chi tiết:
Ka càng lớn tính axit càng mạnh nên ta có sự sắp xếp tính axit như sau:
(2) HOCl < (3) CH3COOH < (1) H3PO4 < (4) H2SO4
Câu 10:
Chọn đáp án D
Phương pháp giải:
Với bài toán cho biết lượng Ca(OH)2 và lượng kết tủa CaCO3, tính lượng CO2 ta xét các trường hợp sau:
TH1: Ca(OH)2 dư, CO2 phản ứng hết, kết tủa không bị hòa tan
CO2 + Ca(OH)2 → CaCO3 + H2O
TH2: Kết tủa bị hòa tan một phần
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Giải chi tiết:
TH1: Ca(OH)2 dư, CO2 phản ứng hết, kết tủa không bị hòa tan
CO2 + Ca(OH)2 → CaCO3 + H2O
BTNT "C" ta có: nCO2 = nCaCO3 = 0,075 mol
=> V CO2 = 0,075.22,4 = 1,68 lít
TH2: Kết tủa bị hòa tan một phần
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
nCaCO3 = 0,075 mol
BTNT "Ca" ta có: nCa(HCO3)2 = nCa(OH)2 – nCaCO3 = 0,1 – 0,075 = 0,025 mol
BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,075 + 0,025.2 = 0,125 mol
=> VCO2 = 0,125.22,4 = 2,8 lít
Câu 11:
Chọn đáp án B
Phương pháp giải:
Ta thấy nH2O > nCO2 => Hợp chất hữu cơ có dạng CnH2n+2Oz
Giải chi tiết:
nCO2 = 3,36 : 22,4 = 0,15 mol
nH2O = 4,5 : 18 = 0,25 mol
Ta thấy nH2O > nCO2 => Hợp chất hữu cơ có dạng CnH2n+2Oz
Khi đó: nX = nH2O – nCO2 = 0,25 – 0,15 = 0,1 mol
Câu 12:
Chọn đáp án B
Phương pháp giải:
nX = mX : MX = ?
nC = nCO2 = ?
=> Số C = nC : nX = ?
Giải chi tiết:
nX = mX : MX = 1,44 : 72 = 0,02 mol
nC = nCO2 = 4,4 : 44 = 0,1 mol
Số C = nC : nX = 0,1 : 0,02 = 5
Câu 13:
Chọn đáp án D
Phương pháp giải:
Tính theo PTHH: NaOH + HCl → NaCl + H2O
Giải chi tiết:
nHCl = 3.0,01 = 0,03 mol
PTHH: NaOH + HCl → NaCl + H2O
nNaOH = nHCl = 0,03 mol
=> V dd NaOH = n : CM = 0,03 : 0,3 = 0,1 lít = 100 ml
Câu 14:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
Độ điện li α của chất điện li phụ thuộc vào những yếu tố:
+ Bản chất của chất điện li
+ Bản chất của dung môi
+ Nhiệt độ và nồng độ của chất tan
Câu 15:
Chọn đáp án C
Phương pháp giải:
Những chất không có phản ứng hóa học với nhau có thể cùng tồn tại trong một dung dịch.
Giải chi tiết:
A loại vì có phản ứng 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2↑ + 6NaCl
B loại vì có phản ứng HNO3 + NaHCO3 → NaNO3 + H2O + CO2↑
C đúng
D loại vì có phản ứng NaCl + AgNO3 → NaNO3 + AgCl↓
Câu 16:
Chọn đáp án B
Phương pháp giải:
Công thức phân tử của chất có dạng là CnH3n
Mặt khác trong hidrocacbon ta luôn có: H ≤ 2C + 2 và H là số chẵn.
Tìm điều kiện của n.
Giải chi tiết:
Công thức phân tử của chất có dạng là CnH3n
Mặt khác trong hidrocacbon ta luôn có: H ≤ 2C + 2
=> 3n ≤ 2n + 2 => n ≤ 2
Mà số H chẵn nên ta suy ra n = 2
=> CTPT C2H6
Câu 17:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
Ta có:
C + H2O → CO + H2 hoặc C + 2H2O → CO2 + 2H2
=> Sản phẩm đều là chất khí
Câu 18:
Chọn đáp án B
Phương pháp giải:
Do số mol NaOH không đổi nên ta có: CV = C’V’
Giải chi tiết:
Do số mol NaOH không đổi nên ta có: CV = C’V’ => V’ = CV/C’ = 1.2/0,1 = 20 lít
=> Số ml cần thêm là: 20 – 2 = 18 lít = 18000 ml
Câu 19:
Chọn đáp án D
Phương pháp giải:
Số mol chất tan không đổi nên nồng độ tỉ lệ nghịch với thể tích. Nồng độ giảm bao nhiêu lần thì thể tích tăng bấy nhiêu lần.
Giải chi tiết:
pH tăng 1 => Nồng độ H+ giảm 10 lần => Thể tích tăng 10 lần
Do đó cần pha loãng 10 lần để từ dung dịch HCl pH = 3 thu được dung dịch HCl pH = 4.
Câu 20:
Chọn đáp án C
Phương pháp giải:
Bài toán CO2 tác dụng với dung dịch kiềm:
Tính tỉ lệ:
+ (*) ≥ 2 => Chỉ tạo muối CO32-
+ 1 < (*) < 2 => Tạo muối CO32- và HCO3-
+ (*) ≤ 1 => Chỉ tạo muối HCO3-
Giải chi tiết:
nOH- = 2nCa(OH)2 = 0,075.2 = 0,15 mol
nCO2 = 2,24 : 22,4 = 0,1 mol
1< nOH-/nCO2 = 0,15 : 0,1 = 1,5 < 2
=> Tạo 2 muối là CaCO3 và Ca(HCO3)2
Câu 21:
Chọn đáp án C
Phương pháp giải:
Muối nào có môi trường trung tính thì có pH = 7
Cách xác định môi trường của một muối:
+ Muối được tạo bởi axit mạnh và bazo yếu thì có môi trường axit, pH < 7
+ Muối được tạo bởi axit yếu và bazo mạnh thì có môi trường bazo, pH > 7
+ Muối được tạo bởi axit mạnh và bazo mạnh thì có môi trường trung tính, pH = 7
Giải chi tiết:
A. Al2(SO4)3 được tạo bởi axit mạnh H2SO4 và bazo yếu Al(OH)3 nên có môi trường axit (pH < 7)
B. NH4NO3 được tạo bởi axit mạnh HNO3 và bazo yếu NH3 nên có môi trường axit (pH < 7)
C. KNO3 được tạo bởi axit mạnh và bazo mạnh nên có môi trường trung tính (pH = 7)
Câu 22:
Chọn đáp án B
Phương pháp giải:
Giải chi tiết:
Các chất vừa tác dụng với HCl và NaOH là: Al, Al2O3, Zn(OH)2, NaHS, (NH4)2CO3
=> Có 5 chất
Câu 23:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
pOH = 14 – pH = 2 => CM NaOH = [OH-] = 0,01M
nNaOH = 0,1.0,01 = 0,001 mol
PTHH: NH4Cl + NaOH → NaCl + NH3 + H2O
Pư: 0,001 0,001
Do phản ứng vừa đủ nên sau khi đun sôi thì NH3 bay hơi hết, dung dịch thu được chỉ còn lại NaCl có môi trường trung tính nên không làm đổi màu dung dịch phenolphtalein.
Câu 24:
Chọn đáp án B
Phương pháp giải:
Giả sử sau phản ứng thu được 100 gam hỗn hợp gồm CO2 và H2O.
mCO2 = 66,165 gam => nCO2 => nC = nCO2 = ?
mH2O = 100 – 66,165 = 33,835 gam => nH2O => nH = 2nH2O = ?
Từ đó suy ra tỉ lệ C : H
Chọn Chọn đáp án thỏa mãn.
Giải chi tiết:
Giả sử sau phản ứng thu được 100 gam hỗn hợp gồm CO2 và H2O.
mCO2 = 66,165 gam => nCO2 = 1,50375 mol => nC = nCO2 = 1,50375 mol
mH2O = 100 – 66,165 = 33,835 gam => nH2O = 1,87972 mol => nH = 2nH2O = 3,75944 mol
Ta có: C : H = 1,50375 : 3,75944 ≈ 0,4
Quan sát các Chọn đáp án thấy B thỏa mãn
Câu 25:
Chọn đáp án B
Phương pháp giải:
Đặt công thức của hidrocacbon X là CxHy
=> x : y
=> Công thức phân tử của chất có dạng là CnH3n
Mặt khác trong hợp chất hữu cơ ta luôn có: H ≤ 2C + 2
Mà số H chẵn nên ta suy ra n = ? => CTPT
Giải chi tiết:
Đặt công thức của hidrocacbon X là CxHy
=> 12x = 0,8(12x + y) => 2,4x = 0,8y => x : y = 1 : 3
=> Công thức phân tử của chất có dạng là CnH3n
Mặt khác trong hợp chất hữu cơ ta luôn có: H ≤ 2C + 2
=> 3n ≤ 2n + 2 => n ≤ 2
Mà số H chẵn nên ta suy ra n = 2
=> CTPT C2H6
