Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 12)
-
4670 lượt thi
-
29 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án B
Phương pháp giải:
Muối axit là muối là muối mà H trong gốc axit vẫn còn khả năng phân li ra H+
→ Muối trung hòa thường không có H (ngoại lệ là , ...)
Giải chi tiết:
Muối axit là muối là muối mà H trong gốc axit vẫn còn khả năng phân li ra H+
→ Muối trung hòa thường không có H (ngoại lệ là , ...)
Vậy:
Na2HPO4, KHCO3, NH4HSO4 là muối axit.
Na2SO3 là muối trung hòa.
Câu 2:
Chọn đáp án B
Phương pháp giải:
Dựa vào phương pháp nhận biết ion PO43- trong dung dịch.
Giải chi tiết:
Để nhận biết ion PO43- người ta thường dùng dung dịch AgNO3 vì sản phẩm có kết tủa màu vàng.
PT ion: 3Ag+ + PO43- → Ag3PO4 (kết tủa vàng)
Câu 3:
Chọn đáp án D
Phương pháp giải:
Tính chất hóa học của P và hợp chất của photpho.
Giải chi tiết:
PTHH: 4P + 5O2 2P2O5 (X)
P2O5 + 3H2O → 2H3PO4 (Y)
Câu 4:
Chọn đáp án C
Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Giải chi tiết:
A có PT ion thu gọn là SO42- + Ba2+ → BaSO4 → loại
B có PT ion thu gọn là 3H+ + Fe(OH)3 → Fe3++ 3H2O → loại
C có PT ion thu gọn là H+ + OH- → H2O → thỏa mãn
D có PT ion thu gọn là OH- + HCO3- → CO32- + H2O → loại
Câu 5:
Chọn đáp án A
Phương pháp giải:
Chất oxi hóa là chất nhận electron => số oxi hóa giảm.
Giải chi tiết:
Xét số oxi hóa của C trong các phản ứng:
- Phương án A số oxi hóa giảm từ 0 xuống -4 => Tính oxi hóa
- Phương án B số oxi hóa tăng từ 0 lên +4 => Tính khử
- Phương án C số oxi hóa tăng từ 0 lên +2 => Tính khử
- Phương án D số oxi hóa tăng từ 0 lên +4 => Tính khử
Câu 6:
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
Thành phần chính của nước đá khô là CO2 rắn
Câu 7:
Để điều chế chất X trong phòng thí nghiệm, người ta cho NaNO3 rắn phản ứng với H2SO4 đặc theo bình sau:
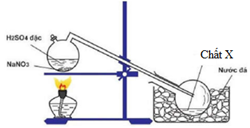
Chất X là:
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
PTHH : NaNO3(rắn) + H2SO4(đặc) NaHSO4 + HNO3
→ Chất X là HNO3
Câu 8:
Cho giá trị pH của một số mẫu chất lỏng sau:
|
Mẫu |
Giấm |
Sữa |
Dịch dạ dày |
Nước mắt |
|
pH |
3 |
6,5 |
1-2 |
7,4 |
Mẫu dịch lỏng nào có nồng độ ion H+ cao nhất?
Chọn đáp án B
Phương pháp giải:
Ta có pH = - log[H+] nên [H+] càng lớn thì pH càng nhỏ
Giải chi tiết:
Ta có pH = - log[H+] nên [H+] càng lớn thì pH càng nhỏ.
Theo bảng, giá trị pH: dịch dạ dày < giấm < sữa < nước mắt
=> Nồng độ H+: Dịch dạ dày > giấm > sữa > nước mắt.
Câu 9:
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
X là than hoạt tính vì than hoạt tính có màu đen (lưu huỳnh màu vàng, đá vôi màu trắng) và có khả năng hấp phụ chất khí độc (than đá không có khả năng này).
Câu 10:
Chọn đáp án D
Phương pháp giải:
AlCl3 là một chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion.
Viết PT phân li và dựa vào nồng độ AlCl3 suy ra nồng độ của ion Al3+ và Cl-.
Giải chi tiết:
AlCl3 là một chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion.
PT phân li: AlCl3 → Al3+ + 3Cl-
0,2M → 0,2M → 0,6M
Câu 11:
Chọn đáp án A
Phương pháp giải:
Chất điện li mạnh là axit mạnh, bazo mạnh và hầu hết các muối.
Giải chi tiết:
- Ba(OH)2, HCl, Na2SO4 là các chất điện li mạnh.
- H2S là chất điện li yếu.
Câu 12:
Chọn đáp án D
Phương pháp giải:
Một số hidroxit lưỡng tính thường gặp: Al(OH)3, Zn(OH)2, Cr(OH)3
Giải chi tiết:
Al(OH)3 là một hidroxit lưỡng tính.
Câu 13:
Chọn đáp án B
Phương pháp giải:
Lý thuyết về phân bón hóa học.
Giải chi tiết:
Phân đạm cung cấp nitơ cho cây trồng dưới dạng ion NO3- và NH4+.
Câu 14:
Chọn đáp án B
Phương pháp giải:
Giải chi tiết:
- Thuốc thử để nhận biết khí NH3 là quỳ tím ẩm vì NH3 làm quỳ tím chuyển sang màu xanh.
- NH3 không phản ứng với 3 chất còn lại nên không dùng 3 chất này để nhận biết.
Câu 15:
Chọn đáp án B
Phương pháp giải:
Xét tỉ lệ nKOH : nH3PO4 = a
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
Nếu a ≤ 1 thì phản ứng chỉ tạo ra KH2PO4
Nếu 1 < a < 2 thì phản ứng tạo 2 muối KH2PO4 và K2HPO4
Nếu a = 2 thì phản ứng chỉ tạo K2HPO4
Nếu 2 < a < 3 thỉ phản ứng tạo 2 muối K2HPO4 và K3PO4
Nếu a ≥ 3 nên phản ứng tạo muối K3PO4
Giải chi tiết:
Vì nKOH : nH3PO4 = 0,3 : 0,2 = 1,5 nên phản ứng tạo 2 muối KH2PO4 và K2HPO4
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
Câu 16:
Chọn đáp án D
Phương pháp giải:
2 chất cùng tồn tại trong dung dịch khi chúng không phản ứng với nhau.
Giải chi tiết:
A. HCl + AgNO3 → AgCl + HNO3
B. KOH + HCl → KCl + H2O
C. NaHCO3 + NaOH → Na2CO3 + H2O
D. NaCl + NH4NO3 → không phản ứng
Nên NaCl và NH4NO3 tồn tại được trong một dung dịch
Câu 17:
Chọn đáp án D
Phương pháp giải:
Chất điện li gồm có axit, bazo và muối.
Giải chi tiết:
Trong các chất đề bài cho thì HCl là một chất điện li.
Câu 18:
Chọn đáp án C
Phương pháp giải:
pH = - log[H+]
Giải chi tiết:
Do nồng độ của HCl >> 10-7 nên có thể bỏ qua sự phân li của H2O.
HCl → H+ + Cl-
0,01M → 0,01M
Ta có: pH = -log[H+] = - log(0,01) = 2
Câu 19:
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
Để khắc chữ trên thủy tinh (thành phần chính là SiO2) người ta dùng dung dịch chứa HF vì:
4HF + SiO2 → SiF4 + 2H2O
Câu 20:
Chọn đáp án C
Phương pháp giải:
Dựa vào phương pháp điều chế N2.
Giải chi tiết:
Trong phòng thí nghiệm, nito được điều chế theo phương trình: NH4Cl + NaNO2 to→→to NaCl + N2 + 2H2O
Câu 21:
Chọn đáp án C
Phương pháp giải:
Tính theo PTHH: NaOH + HNO3 → NaNO3 + H2O
Giải chi tiết:
PTHH: NaOH + HNO3 → NaNO3 + H2O
0,2 → 0,2 (mol)
→ V = 0,2 : 2 = 0,1 lít = 100 ml
Câu 22:
Chọn đáp án A
Phương pháp giải:
- Nếu M là [K, ..., Ca] thì nhiệt phân thu được muối M(NO2)n và O2
- Nếu M là [Mg, ..., Cu] thì nhiệt phân thu được M2On, NO2, O2
Ngoại lệ: 2Fe(NO3)2 → Fe2O3 + 4NO2 + 0,5O2
- Nếu M là [Ag, ...] thì nhiệt phân thu được M, NO2, O2
Giải chi tiết:
PTHH: 2Cu(NO3)2 2CuO + 2NO2 + O2
Nhiệt phân hoàn toàn Cu(NO3)2 thu được các sản phẩm là CuO, NO2, O2
Câu 23:
Chọn đáp án B
Phương pháp giải:
Dung dịch có pH < 7 là dung dịch có MT axit.
Giải chi tiết:
Dung dịch có pH < 7 là dung dịch có MT axit → Dung dịch là axit hoặc là muối của axit mạnh và bazo yếu
→ HCl là dung dịch axit thỏa mãn
Câu 24:
Chọn đáp án C
Phương pháp giải:
Dung dịch làm quỳ tím chuyển xanh là dung dịch mang tính bazo → Dung dịch bazo hoặc là muối của bazo mạnh và axit yếu.
Giải chi tiết:
Dung dịch làm quỳ tím chuyển xanh là dung dịch mang tính bazo → Dung dịch bazo hoặc là muối của bazo mạnh và axit yếu
→ Dung dịch NaOH thỏa mãn
Câu 25:
Viết phương trình dạng phân tử và ion thu gọn của các phản ứng sau
a. BaCl2 + K2SO4 →
BaCl2 + K2SO4 → BaSO4 ↓ + 2KCl
→ Phương trình ion thu gọn là Ba2+ + SO42- → BaSO4 ↓
Câu 26:
b. Na2CO3 + … → CO2 + … + …
Na2CO3 +2HCl → CO2 ↑ + 2NaCl + H2O
→ Phương trình ion thu gọn là CO32- + 2H+ → H2O + CO2 ↑
Câu 27:
Hấp thụ hoàn toàn 6,72 lít khí (đktc) khí CO2 vào 400 ml dung dịch KOH 2M. Tính nồng độ mol của các chất có trong dung dịch sau phản ứng (giả sử thể tích dung dịch không thay đổi).
Phương pháp giải:
Lập tỉ lệ: nKOH / nCO2 = a
KOH + CO2 → KHCO3
2KOH + CO2 → K2CO3 + H2O
Nếu a ≤ 1 thì phản ứng chỉ tạo KHCO3
Nếu 1 < a < 2 phản ứng tạo 2 muối K2CO3 và KHCO3
Nếu a ≥ 2 thì phản ứng chỉ tạo K2CO3
Giải chi tiết:
Ta có nCO2 = 0,3 mol và nKOH = 0,8 mol
Vì nKOH / nCO2 = 2,67 nên phản ứng chỉ tạo ra muối K2CO3 và còn dư KOH
PTHH : 2KOH + CO2 → K2CO3 + H2O
0,6 ← 0,3 → 0,3 mol
→ nKOH dư = 0,8 - 0,6 = 0,2 mol
Nồng độ mol các chất có trong dung dịch sau phản ứng là
CM KOH = 0,2 : 0,4 = 0,5M
CM K2CO3 = 0,3 : 0,4 = 0,75M
Câu 28:
Cho 1,92 gam Cu vào dung dịch HNO3 1,5M loãng lấy dư thu được V lít khí NO (đktc) và dung dịch A. Biết khí NO sinh ra là sản phẩm khử duy nhất của các phản ứng, các phản ứng xảy ra hoàn toàn.
a. Tính V
Phương pháp giải:
Tính theo PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Giải chi tiết:
nCu = 1,92 : 64 = 0,03 mol
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
0,03 → 0,08 → 0,03 → 0,02 (mol)
→ V = 0,448 lít
Câu 29:
b. Cho dung dịch A tác dụng với Fe dư, thấy khối lượng Fe đã phản ứng là 2,52 gam và sinh ra khí NO. Tính thể tích dung dịch HNO3 1,5M đã dùng
Phương pháp giải:
Cho dd A tác dụng với Fe dư:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (1)
Fe + Cu2+ → Fe2+ + Cu (2)
Giải chi tiết:
Cho dd A tác dụng với Fe dư: nFe = 0,045 mol
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (1)
Fe + Cu2+ → Fe2+ + Cu (2)
0,03 ← 0,03 mol
→ nFe (1) = nFe – nFe(2) = 0,045 – 0,03 = 0,015 mol → nHNO3(1) = 8/3.nFe(1) = 0,04 mol
→ nHNO3 ban đầu = 0,08 + 0,04 = 0,12 mol → VHNO3 = 0,12 : 1,5 = 0,08 lít
