Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 17)
-
4707 lượt thi
-
24 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án D
Phương pháp giải:
Tính theo PTHH: 3NaOH + H3PO4 → Na3PO4 + 3H2O
Giải chi tiết:
PTHH : 3NaOH + H3PO4 → Na3PO4 + 3H2O
0,009 ← 0,003 0,003 mol
→ CM = n : V → a = 0,009 : 0,03 = 0,3M
Câu 2:
Chọn đáp án B
Phương pháp giải:
Bảo toàn điện tích: 2nCa2+ + 2nBa2+ = nCl– + nHCO3– → a
Khi đun nóng X: 2HCO3– CO32– + H2O + CO2
→ nHCO3– = ½.a → mmuối = mCa2+ + mBa2+ + mCl– + mCO32–
Giải chi tiết:
Bảo toàn điện tích: 2nCa2+ + 2nBa2+ = nCl– + nHCO3– → 0,2.2 + 0,1.2 = 0,2.1 + a → a = 0,4 mol
Khi đun nóng X: 2HCO3– CO32– + H2O + CO2
→ nCO3– = ½.a = 0,2 mol
Ta có: mmuối = mCa2+ + mBa2+ + mCl– + mCO32– = 0,2.40 + 0,1.137 + 0,2.35,5 + 0,2.60 = 40,8 gam
Câu 3:
Chọn đáp án A
Phương pháp giải:
Tính khử là khả năng nhường electron của chất, chất đó sẽ tăng số oxi hóa.
Giải chi tiết:
A. Cacbon tăng số oxi hóa C0 lên C+4 → tính khử
B. Cacbon giảm số oxi hóa từ 0 xuống – 4 → tính oxi hóa
C. Cacbon giảm số oxi hóa từ 0 xuống –1 (CaC2) và cả số oxi hóa tăng từ 0 lên +2 (CO) → cả tính khử và oxi hóa
D. Cacbon giảm số oxi hóa từ 0 xuống –4 → tính oxi hóa
Câu 4:
Chọn đáp án C
Phương pháp giải:
Giả sử 1 mol khí trao đổi n mol electron.
Áp dụng bảo toàn e: 2nMg = n.n khí → Giá trị của n
+ n = 1 → NO2
+ n = 3 → NO
+ n = 8 → N2O
+ n = 10 → N2
Giải chi tiết:
nMg = 0,1 mol và nX = 0,02 mol
Giả sử 1 mol khí trao đổi n mol electron
Áp dụng bảo toàn e: 2nMg = n.n khí → 2.0,1 = 0,02.n → n = 10
→ Khí là N2
Câu 5:
Có ba dung dịch riêng biệt: H2SO4 1M; NaNO3 1M; HNO3 1M được đánh số ngẫu nhiên là (1), (2), (3).
– Trộn 5 ml dung dịch (1) với 5 ml dung dịch (2), thêm bột Cu dư, thu được V1 lít khí NO.
– Trộn 5 ml dung dịch (1) với 5 ml dung dịch (3), thêm bột Cu dư, thu được 3V1 lít khí NO.
– Trộn 5 ml dung dịch (3) với 5 ml dung dịch (2), thêm bột Cu dư, thu được V2 lít khí NO.
Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. So sánh nào sau đây đúng?
Chọn đáp án A
Phương pháp giải:
3Cu + 8H++ 2NO3– → 3Cu2+ + 2NO + 4 H2O (1)
TN1: V1 lít
TN2: 3V1 lít
Nhận thấy: nH+ (TN2) = 3nH+ (TN1) → Thí nghiệm 2 có H2SO4 và HNO3 trong khí thí nghiệm 1 chỉ có HNO3
→ (1) là HNO3; (2) là NaNO3; (3) là H2SO4
Sau đó dựa vào PT (1) để tính nNO thoát ra ở các thí nghiệm 1 và 3. Từ đó suy ra V2 và V1
Giải chi tiết:
3Cu+ 8H++ 2NO3– → 3Cu2++ 2NO + 4 H2O
TN1: V1 lít
TN2: 2V1 lít
Nhận thấy: nH+ (TN2)= 2nH+ (TN1) → Thí nghiệm 2 có H2SO4 trong khí thí nghiệm 1 chỉ có HNO3
→ (1) là NaNO3; (2) là HNO3; (3) là H2SO4
Ta có: TN1 thì nH+ = 5.10–3 mol và NO3–: 10.10–3 mol
TN2 thì nH+= 10.10–3 mol và NO3–: 5.10–3 mol
3Cu+ 8H+ + 2NO3– → 3Cu2++ 2NO + 4 H2O
TN1: Bđ: 5.10–3 10.10–3
Pư: 5.10–3→ 1,25.10–3
TN3: Bđ: 10.10–3 5.10–3
Pư: 10.10–3 → 2,5.10–3
Các thể tích khí đo ở cùng điều kiện nên nNO(TN3) = 2nNO (TN1) → VNO(TN3) = 2VNO (TN1) hay V2 = 2V1
Câu 6:
Chọn đáp án C
Trong điều kiện thường Si tan được trong dung dịch NaOH:
2NaOH + Si + H2O → Na2SiO3 + 2H2
Câu 7:
Cho m gam hỗn hợp X gồm Na và Ca vào một lượng nước dư, thu được dung dịch Y. Sục từ từ cho đến dư khí CO2 vào Y, số mol kết tủa CaCO3 phụ thuộc vào số mol CO2 theo đồ thị sau:
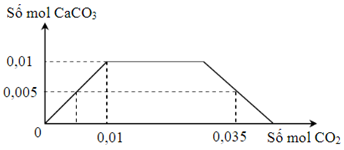
Khối lượng của Na trong m gam X là
Chọn đáp án C
Phương pháp giải:
Đặt số mol của Na và Ca trong X lần lượt là x và y mol
Bảo toàn Na có nNaOH = x mol
Bảo toàn Ca có nCa(OH)2 = y mol → nOH– = x + 2y (mol)
Khi sục CO2 vào thì kết tủa max khi nCa2+ = nCaCO3 → y
Xét thời điểm nCO2 = 0,035 mol thì xảy ra cả phản ứng tạo CO32– và HCO3–
CO2 + 2OH– → CO32– + H2O
CO2 + OH– → HCO3–
Ca2+ + CO32– → CaCO3
Ta có nCO32– = nCaCO3
Bảo toàn C có nHCO3– = nCO2 – nCO32– → nOH– phản ứng = 2nCO32– + nHCO3– → x + 2y → x
Giải chi tiết:
Đặt số mol của Na và Ca trong X lần lượt là x và y mol
Bảo toàn Na có nNaOH = x mol
Bảo toàn Ca có nCa(OH)2 = y mol
→ nOH– = x + 2y (mol)
Khi sục CO2 vào thì kết tủa max khi nCa2+ = nCaCO3 = 0,01 mol = y
Xét thời điểm nCO2 = 0,035 mol thì xảy ra cả phản ứng tạo CO32– và HCO3–
CO2 + 2OH– → CO32– + H2O
CO2 + OH– → HCO3–
Ca2+ + CO32– → CaCO3
Ta có nCO32– = nCaCO3 = 0,005 mol
Bảo toàn C có nHCO3– = nCO2 – nCO32– = 0,035 – 0,005 = 0,03 mol
→ nOH– phản ứng = 2nCO32– + nHCO3– = 2.0,005 + 0,03 = 0,04 mol
→ x + 2y = 0,04 → x = 0,04 – 2y = 0,02 mol ( y = 0,01 mol) → mNa = 0,02.23 = 0,46 gam
Câu 8:
Chọn đáp án B
Phương pháp giải:
Chất điện li là axit, bazơ và hầu hết các muối.
Giải chi tiết:
Chất điện li ở dây là NaCl (muối ăn) – natri clorua.
Câu 9:
Chọn đáp án B
Phương pháp giải:
Có 3 loại môi trường:
– MT trung tính có pH = 7
– MT axit có pH < 7
– MT kiềm có pH > 7
Giải chi tiết:
Ở 25oC, môi trường trung tính có pH = 7.
Câu 10:
Chọn đáp án A
Phương pháp giải:
Nhiệt phân muối nitrat M(NO3)n
– Nếu M là [K, ..., Ca] thì nhiệt phân thu được muối M(NO2)n và O2
– Nếu M là [Mg, ..., Cu] thì nhiệt phân thu được M2On, NO2, O2
Ngoại lệ: 2Fe(NO3)2 → Fe2O3 + 4NO2 + 0,5O2
– Nếu M là [Ag, ...] thì nhiệt phân thu được M, NO2, O2
Giải chi tiết:
Khi nhiệt phân hoàn toàn muối Cu(NO3)2 thu được sản phẩm là CuO, NO2, O2.
PTHH: 2Cu(NO3)2 2CuO +2NO2 + O2
Câu 11:
Chọn đáp án D
Phương pháp giải:
Lý thuyết về phân bón hóa học.
Giải chi tiết:
Phân lân cung cấp nguyên tố photpho (P) cho cây trồng.
Câu 12:
Chọn đáp án D
Phương pháp giải:
Muối axit là muối chứa gốc axit còn có khả năng phân li ra H+.
Chú ý: Muối HPO3– và HPO2– không phải là muối axit.
→ Muối trung hòa là các muối còn lại: không có H+ hoặc là các muối có gốc HPO3– và HPO2–
Giải chi tiết:
Na2SO4 là muối trung hòa.
Câu 13:
Chọn đáp án B
Phương pháp giải:
Viết PTHH nhận định màu kết tủa.
Giải chi tiết:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl → kết tủa BaSO4 là kết tủa trắng
Câu 14:
Chọn đáp án A
Phương pháp giải:
Từ nHCl → nH+
H+ + OH– → H2O → nOH–
Giải chi tiết:
nHCl = 0,01 mol → nH+
H+ + OH– → H2O
→ nOH– = → nH+ = 0,01 mol → a = 0,01 : 0,02 = 0,5M
Câu 15:
Chọn đáp án C
Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Giải chi tiết:
Phương trình phân tử: KOH + HCl → KCl + H2O
→ Phương trình ion rút gọn là: OH– + H+ → H2O
Câu 16:
Chọn đáp án A
Chất khí độc dẫn đến tử vong nhẹ hơn không khí là CO do CO có ái tính với hemoglobin trong máu mạnh hơn, ngăn cản hemoglobin vận chuyển oxi trong máu.
→ Biện pháp: Không dùng trong phòng kín mà phải để cửa thoáng.
Câu 17:
Chọn đáp án D
+ CO2 và NH3 điều kiện thường là chất khí
+ H3PO4 là chất rắn còn HNO3 là chất lỏng
Câu 18:
Chọn đáp án C
Phương pháp giải:
Các ion cùng tồn tại trong một dung dịch khi chúng không phản ứng với nhau.
Giải chi tiết:
A sai vì Ba2+ + SO42– → BaSO4
B sai vì Al3+ + 3OH– → Al(OH)3
C đúng vì các ion không phản ứng với nhau
D sai vì Ba2+ + CO32– → BaCO3 hoặc Mg2+ + CO32– → MgCO3
Câu 19:
Thực hiện các thí nghiệm sau:
(a) Đốt cháy NH3 trong không khí;
(b) Cho NO tác dụng với O2 ở nhiệt độ thường;
(c) Đốt cháy P trong O2 dư;
(d) Cho kim loại Cu tác dụng với dung dịch HNO3 đặc, nóng.
Số thí nghiệm xảy ra phản ứng oxi hóa – khử là
Chọn đáp án D
Phương pháp giải:
Phản ứng oxi hóa khử là phản ứng có xảy ra sự nhường và nhận e, biểu hiện bằng thay đổi số oxi hóa.
Giải chi tiết:
(a) NH3 + O2 H2O + NO → phản ứng oxi hóa – khử
(b) NO + O2 → 2NO → phản ứng oxi hóa – khử
(c) 4P + 5O2 2P2O5 → phản ứng oxi hóa – khử
(d) 3Cu + 8HNO3 đặc 3Cu(NO3)2 + 4H2O + 2NO → phản ứng oxi hóa khử
Số thí nghiệm xảy ra phản ứng oxi hóa – khử là 4.
Câu 20:
Chọn đáp án B
Phương pháp giải:
Xem lại điều chế NH3.
Giải chi tiết:
Phản ứng điều chế NH3 trong phòng thí nghiệm:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O.
Câu 21:
Viết phương trình phân tử và phương trình ion rút gọn của phản ứng hóa học xảy ra trong các thí nghiệm sau:
a) Cho dung dịch Na2SO4 tác dụng với dung dịch Ba(OH)2.
Phương trình phân tử: Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH
→ Phương trình ion thu gọn: Ba2+ + SO42– → BaSO4
Câu 22:
b) Cho dung dịch KHCO3 tác dụng với dung dịch KOH.
Phương trình phân tử: KHCO3 + KOH → K2CO3 + H2O
→ Phương trình ion thu gọn: HCO3– + OH– → CO32– + H2O
Câu 23:
Hòa tan hoàn toàn 2,16 gam hỗn hợp X gồm Fe và Fe2O3 trong dung dịch HNO3 dư, thu được 0,224 lít khí NO (là sản phẩm khử duy nhất, ở đktc).
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính phần trăm khối lượng các chất trong X.
c. Tính số mol HNO3 phản ứng.
a.
Phương pháp giải:
Fe + 4HNO3 → Fe(NO3)3 + 2H2O + NO Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Giải chi tiết:
Fe + 4HNO3 → Fe(NO3)3 + 2H2O + NO
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
b.
Phương pháp giải:
nNO → nFe → mFe → mFeO
Giải chi tiết:
nNO = 0,01 mol → nFe = 0,01 mol → mFe = 0,56 gam
→ mFeO = 2,16 – 0,56 = 1,6 gam
c.
Phương pháp giải:
nHNO3 phản ứng = 4nFe + 6nFe2O3
Giải chi tiết:
Ta có: nFe2O3 = 0,01 mol
→ nHNO3 phản ứng = 4nFe + 6nFe2O3 = 4.0,01 + 6.0,01 = 0,1 mol
Câu 24:
Hòa tan hoàn toàn 3,76 gam hỗn hợp X gồm S, FeS và FeS2 trong dung dịch HNO3 dư, thu được dung dịch Y và 0,48 mol NO2 (sản phẩm khử duy nhất). Cho dung dịch Ba(OH)2 dư vào Y, sau khi kết thúc các phản ứng, thu được kết tủa T. Nung T đến khối lượng không đổi, thu được m gam chất rắn. Tính m.
Phương pháp giải:
Quy đổi hỗn hợp trên thành x mol Fe và y mol S.
Dùng định luật bảo toàn e và mX để tìm x và y
Chất rắn Z chứa Fe2O3 và BaSO4.
Bảo toàn nguyên tố Fe và S ta có: nFe2O3 = ½.nFe; nBaSO4 = nS
Vậy m = mFe2O3+ mBaSO4
Giải chi tiết:
Quy đổi hỗn hợp trên thành x mol Fe và y mol S.
Ta có:
Fe → Fe3++ 3e S → S6++ 6e
N+5+ 1e → N+4
Áp dụng bảo toàn electron ta có: 3x + 6y = 0,48 mol
Mặt khác: 56x + 32y = 3,76 g
Giải hệ trên thu được x = 0,03 mol và y = 0,065 mol
→ Trong Y có Fe3+: 0,03 mol và SO42–: 0,065 mol; H+; NO3–
→ Y + Ba(OH)2:
Ba2+ + SO42– → BaSO4
Fe3+ + 3OH– → Fe(OH)3
2 Fe(OH)3 Fe2O3 + 3H2O
Chất rắn sau nung chứa Fe2O3 và BaSO4.
Bảo toàn nguyên tố Fe và S ta có: nFe2O3 = ½.nFe = 0,015 mol; nBaSO4 = nS = 0,065 mol.
Vậy m = mFe2O3+ mBaSO4 = 0,015.160 + 0,065.233 = 17,545 gam
