Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 16)
-
4761 lượt thi
-
23 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án B
Công thức hoá học của supephotphat kép là Ca(H2PO4)2.
Câu 2:
Cho các phản ứng sau:
(1) N2 + O2 2NO
(2) N2 + 3H2 2NH3
Trong hai phản ứng trên thì nitơ
Chọn đáp án B
Phương pháp giải:
Chất khử là chất nhường electron nên số oxi hóa tăng
Chất oxi hóa là chất nhận electron nên số oxi hóa giảm
Giải chi tiết:
(1) nitơ thể hiện tính khử vì số oxi hóa của N tăng N0 → N+2
(2) nitơ thể hiện tính oxi hóa vì số oxi hóa của N giảm N0 → N–3
Câu 3:
Cho 4 lọ dung dịch riêng biệt X, Y, Z, T chứa các chất khác nhau trong số 4 chất: (NH4)2CO3, NaHCO3, NaNO3, NH4NO3. Thực hiện nhận biết bốn dung dịch trên bằng dung dịch Ba(OH)2 thu được kết quả sau:
|
Chất |
X |
Y |
Z |
T |
|
Dung dịch Ba(OH)2 |
Kết tủa trắng |
Khí mùi khai |
Không hiện tượng |
Kết tủa trắng, khí mùi khai |
Nhận xét nào sau đây là đúng?
Phương pháp giải:
Dựa vào chất sản phẩm khi cho 4 chất trên vào dung dịch Ba(OH)2
Ba(OH)2 + (NH4)2CO3 → BaCO3 ↓ + 2NH3 ↑ + 2H2O
Ba(OH)2 + NaHCO3 → BaCO3 ↓ + NaOH + H2O
Ba(OH)2 + NaNO3 → không phản ứng
Ba(OH)2 + NH4NO3 → Ba(NO3)2 + NH3 ↑ +H2O
Giải chi tiết:
Ba(OH)2 + (NH4)2CO3 → BaCO3 ↓ + 2NH3 ↑+ 2H2O
Ba(OH)2 + NaHCO3 → BaCO3 ↓ + NaOH + H2O
Ba(OH)2 + NaNO3 → không phản ứng
Ba(OH)2 + NH4NO3 → Ba(NO3)2 + NH3 ↑ +H2O
Qua 4 phương trình trên ta thấy
X tạo kết tủa trắng với Ba(OH)2 nên X là NaHCO3 → B sai
Y tạo khí mùi khai với Ba(OH)2 nên Y là NH4NO3 → D sai
Z không hiện tượng khi phản ứng với Ba(OH)2 nên Z là NaNO3 → A sai
T tạo cả kết tủa trắng và khí mùi khai với Ba(OH)2 nên T là (NH4)2CO3 → C đúng
Câu 4:
Phương pháp giải:
Dựa vào điều kiện để xảy ra phản ứng trao đổi ion trong dung dịch.
Giải chi tiết:
Phản ứng trao đổi ion trong các dung dịch điện li xảy ra khi sản phẩm tạo thành có ít nhất 1 trong 3 loại chất: kết tủa, chất bay hơi, chất điện li yếu.
Câu 5:
Chọn đáp án C
Phương pháp giải:
– Đặt số oxi hóa của X khi tác dụng với HNO3 là +n
– Viết các quá trình cho – nhận e. Áp dụng định luật bảo toàn electron để lập biểu thức mối liên hệ giữa M và n.
– Biện luận để tìm giá trị M, n thỏa mãn.
Giải chi tiết:
nN2 = 0,01 mol
Đặt số oxi hóa của X khi tác dụng với HNO3 là +n
QT cho e: X0 → X+n + n e
QT nhận e: 2N+5 + 10e → N2
Áp dụng định luật bảo toàn e: nX.n = 10.nN2 →
Thay các giá trị n = 1, 2, 3 vào biểu thức thấy với n = 2 và X = 24 (Mg) thỏa mãn.
Câu 6:
Chọn đáp án D
Khí CO2 là nguyên nhân chính gây ra hiện tượng hiệu ứng nhà kính.
Câu 7:
Chọn đáp án A
Phương pháp giải:
Ta có pH = –log [H+] → [H+] càng lớn thì pH càng nhỏ
Xét giá trị pH thì:
+ Nếu pH < 7 thì dung dịch có MT axit → quỳ tím hóa đỏ
+ Nếu pH = 7 dung dịch có MT trung tính → quỳ tím không đổi màu
+ Nếu pH > 7 thì dung dịch có MT bazơ → quỳ tím hóa xanh
Giải chi tiết:
pH = –log [H+] → [H+] càng lớn thì pH càng nhỏ → A đúng, B sai
Nếu pH > 7 thì dung dịch có MT bazơ → quỳ tím hóa xanh → C sai
Nếu pH < 7 thì dung dịch có MT axit → quỳ tím hóa đỏ → D sai
Câu 8:
Chọn đáp án A
Phương pháp giải:
Bảo toàn điện tích có nion dương = nion âm → phương trình (1) ẩn a, b
Khối lượng muối khan là mmuối = ∑mion → phương trình (2) ẩn a, b
Giải (1) và (2) thu được a, b
Giải chi tiết:
Bảo toàn điện tích: 2nMg2+ + 2nAl3+ = 2nSO42– + nNO3– => 2a + 3b = 0,1.2 + 0,6 = 0,8 (1)
Ta có: mmuối = mion = mMg2+ + mAl3+ + mSO42– + mNO3– => 24a + 27b + 0,1.96 + 0,6.62 = 54,6 (2)
Giải (1) và (2) có a = 0,1 mol và b = 0,2 mol
Câu 9:
Chọn đáp án B
Phương pháp giải:
Xét tỉ lệ nNaOH : nH3PO4 = a
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Nếu a ≤ 1 thì phản ứng chỉ tạo ra NaH2PO4
Nếu 1 < a < 2 thì phản ứng tạo 2 muối NaH2PO4 và Na2HPO4
Nếu a = 2 thì phản ứng chỉ tạo Na2HPO4
Nếu 2 < a < 3 thỉ phản ứng tạo 2 muối Na2HPO4 và Na3PO4
Nếu a ≥ 3 nên phản ứng tạo muối Na3PO4
Giải chi tiết:
nNaOH = 0,5 mol và nH3PO4 = 0,2 mol
Vì nNAOH : nH3PO4 = 0,5 : 0,2 = 2,5 nên phản ứng tạo 2 muối Na3PO4 và Na2HPO4
PTHH:
3NaOH + H3PO4 → Na3PO4 + 3H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
Câu 10:
Chọn đáp án B
Phương pháp giải:
Axit là chất có khả năng nhường proton (H+).
Giải chi tiết:
– Khi phản ứng với Fe2O3, HNO3 thể hiện tính axit.
– Khi phản ứng với Fe(OH)2, FeO, FeS thì HNO3 thể hiện tính oxi hóa.
Câu 11:
Chọn đáp án A
Phương pháp giải:
Theo thuyết A–rê–ni–ut thì axit là chất có khả năng phân li ra H+
Giải chi tiết:
H2SO4 → 2H+ + SO42–
Ca(OH)2 → Ca2+ + 2OH–
NaCl → Na+ + Cl–
NaHCO3 → Na+ + HCO3–
Theo thuyết A–rê–ni–ut thì axit là chất có khả năng phân li ra H+ → H2SO4 là axit
Câu 12:
Cho các phản ứng sau:
(1) Ca(OH)2 + Na2CO3 → (4) (NH4)2CO3 + Ca(NO3)2 →
(2) Ca(HCO3)2 + NaOH → (5) Ca(HCO3)2 + Ca(OH)2 →
(3) Na2CO3 + CaCl2 → (6) K2CO3 +Ca(NO3)2 →
Có bao nhiêu phản ứng có cùng phương trình ion rút gọn là: Ca2+ + CO32–→ CaCO3↓
Chọn đáp án A
Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Giải chi tiết:
(1) đúng
(2) sai vì phương trình thu gọn là HCO3– + Ca2++ OH– → CaCO3 + H2O
(3) đúng
(4) đúng
(5) sai vì phương trình ion thu gọn là HCO3– + Ca2++ OH– → CaCO3 + H2O
(6) đúng
Vậy có 4 phản ứng có cùng phương trình ion rút gọn là: Ca2+ + CO32–→ CaCO3↓
Câu 13:
Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphtalein.
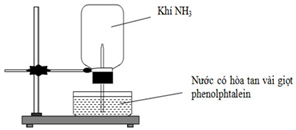
Hiện tượng xảy ra trong thí nghiệm là:
Chọn đáp án B
Phương pháp giải:
Ghi nhớ tính chất của amoniac:
+ NH3 tan tốt trong nước
+ NH3 khi tan trong nước tạo thành dung dịch bazơ yếu
Giải chi tiết:
– Do NH3 tan tốt trong nước nên thể tích NH3 trong bình giảm → nước phun vào bình.
– Khi NH3 tan trong nước thì tạo thành dung dịch bazơ yếu nên làm nước hòa tan sẵn phenolphthalein chuyển màu hồng
→ Hiện tượng: Nước phun vào bình và chuyển thành màu hồng.
Câu 14:
Chọn đáp án D
Phương pháp giải:
H2SO4 là axit mạnh phân li hoàn toàn thành ion: H2SO4 → 2H+ + SO42–
→ [H+] → pH = –log[H+]
Giải chi tiết:
H2SO4 là axit mạnh phân li hoàn toàn thành ion:
H2SO4 → 2H+ + SO42–
0,01M → 0,02M
→ [H+] = 0,02M → pH = –log[H+] = –log0,02 = 1,7 < 2
Câu 15:
Chọn đáp án C
Phương pháp giải:
Chất điện li gồm có axit, bazơ và muối.
Giải chi tiết:
– HCl là axit, KOH là bazơ, NaCl là muối → 3 chất là chất điện li
– C2H5OH là chất không điện li
Câu 16:
Chọn đáp án A
A đúng vì photpho trắng bốc cháy trong không khí khi nhiệt độ trên 40oC → bảo quản trong nước
B sai vì P trắng đun nóng ở 250oC trong điều kiện không có không khí mới chuyển thành photpho đỏ
C sai vì photpho trắng không tan trong nước và photpho trắng rất độc
D sai vì photpho trắng phát quang màu lục nhạt trong bóng tối
Câu 17:
Chọn đáp án A
Phương pháp giải:
HS ghi nhớ một số KL thụ động trong HNO3 đặc nguội: Al, Fe, Cr.
Giải chi tiết:
Một số KL thụ động khi gặp HNO3 đặc nguội: Al, Fe, Cr.
Câu 18:
Chọn đáp án D
Phương pháp giải:
CO chỉ khử được những oxit của KL đứng sau Al.
Như vậy CO chỉ khử được CuO, không khử được Al2O3
PTHH: CO + CuO Cu + CO2
Giải chi tiết:
CO chỉ khử được những oxit của KL đứng sau Al.
Như vậy CO chỉ khử được CuO, không khử được Al2O3
Đặt nCuO = x (mol)
PTHH: CO + CuO Cu + CO2
x ← x → x (mol)
Bảo toàn khối lượng: mCO + mhh ban đầu = mrắn + mCO2 → 28x + 9,1 = 8,3 + 44x → x = 0,05 mol
→ mCuO = 0,05.80 = 4 gam
Câu 19:
Viết phương trình dạng phân tử của các phản ứng hóa học sau:
a) NH4Cl + NaOH → NH3↑ + .... + .....
a) NH4Cl + NaOH → NH3↑ + NaCl + H2O
Câu 20:
b) CaCO3 (rắn) + HCl → ....+ ... + ...
b) CaCO3 (rắn) + 2HCl → CaCl2 + H2O + CO2↑
Câu 22:
Cho m gam hỗn hợp gồm A gồm Cu và Fe tác dụng với 200 ml dung dịch HNO3 đặc, nóng 1M (axit dư), thu được 3,68 gam khí NO2 là sản phẩm khử duy nhất và dung dịch X. Mặt khác cũng cho m gam hỗn hợp A tác dụng với dung dịch HCl dư thu được 0,448 lít khí (đktc).
1) Tính tỉ lệ % về khối lượng của mỗi kim loại trong A.
Ta có: nNO2 = 3,68/46 = 0,08 mol; nH2 = 0,448/22,4 = 0,02 mol
*Khi A tác dụng với HCl dư thì chỉ có Fe phản ứng.
PTHH: Fe + 2HCl → FeCl2 + H2
Từ PTHH => nFe = nH2 = 0,02 mol
*Khi A tác dụng với HNO3 đặc, nóng dư:
QT cho – nhận e:
;
Bảo toàn e: 3nFe + 2nCu = nNO2 => 3.0,02 + 2nCu = 0,08 => nCu = 0,01 mol
Phần trăm khối lượng của mỗi kim loại trong A là:
Câu 23:
– Dung dịch X có Cu(NO3): 0,01 mol; Fe(NO3)3: 0,02 mol
Bảo toàn nguyên tố N: nHNO3 ban đầu = 2nCu(NO3)2 + 3nFe(NO3)3 + nNO2 + nHNO3(X)
→ 0,2.1 = 2.0,01 + 3.0,02 + 0,08 + nHNO3(X) → nHNO3(X) = 0,04 mol
– Khi cho X + Ba(OH)2:
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
3Ba(OH)2 + 2Fe(NO3)3 → 2Fe(OH)3 + 3Ba(NO3)2
Ba(OH)2 + Cu(NO3)2 → Cu(OH)2 + Ba(NO3)2
→ nBa(OH)2 = 0,5.nHNO3(X) + 1,5.nFe(NO3)3 + nCu(NO3)2 = 0,5.0,04 + 1,5.0,02 + 0,01 = 0,06 mol
→ V = n : CM = 0,06 : 0,5 = 0,12 lít = 120ml
