Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 29)
-
4675 lượt thi
-
26 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
Khi cho dung dịch Ba(OH)2 dư vào các dung dịch trên và đun nóng
+) Nếu ống nghiệm xuất hiện kết tủa trắng đồng thời thoát ra khí mùi khai thì đó là (NH4)2SO4
+) Nếu ống nghiệm thoát ra khí mùi khai là NH4Cl
+) Nếu ống nghiệm xuất hiện kết tủa trắng là MgCl2
+) Nếu ống nghiệm không có hiện tượng là NaNO3
PTHH: Ba(OH)2 + (NH4)2SO4 → BaSO4 ↓ + 2NH3 ↑ + 2H2O
Ba(OH)2 + 2NH4Cl → BaCl2 + NH3 ↑ + H2O
Ba(OH)2 + MgCl2 → Mg(OH)2 ↓ + BaCl2
Câu 2:
Cho sơ đồ thử tính dẫn điện của các chất như hình vẽ. Bóng đèn không sáng khi X là
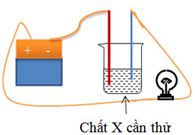
Chọn đáp án D
Phương pháp giải:
Dung dịch điện li có thể dẫn điện.
Giải chi tiết:
Để bóng đèn sáng thì dung dịch X cần thử là dung dịch điện li
→ X không sáng khi X là KCl rắn khan là vì KCl khan không phải là chất điện li
Câu 3:
Chọn đáp án C
Phương pháp giải:
Ion được tách khỏi dung dịch khi nó tạo thành kết tủa hoặc chất khí.
Giải chi tiết:
Dung dịch ban đầu: Na+, H+, Ba2+, Mg2+, Cl-
A. Dùng dung dịch NaOH vừa đủ thì tách được H+, Mg2+:
H+ + OH- → H2O
Mg2+ + 2OH- → Mg(OH)2 ↓
B. Dùng dung dịch KCl vừa đủ không tách được ion nào, thêm ion K+
C. Dùng dung dịch Na2CO3 vừa đủ thì tách được Ba2+, Mg2+ và H+:
Ba2+ + CO32- → BaCO3 ↓
Mg2+ + CO32- → MgCO3 ↓
2H+ + CO32- → H2O + CO2 ↑
D. Dùng dung dịch K2SO4 vừa đủ thì tách được ion Ba2+:
Ba2+ + SO42- → BaSO4 ↓
→ Dùng Na2CO3 tách được nhiều ion nhất
Câu 4:
Chọn đáp án C
Phương pháp giải:
Các phản ứng giữa các ion:
OH- + H+ → H2O
Fe3+ + 3OH- → Fe(OH)3
Al3+ + 3OH- → Al(OH)3
→ nếu nOH- dư → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
Ba2+ +SO42- → BaSO4
Giải chi tiết:
Ta có: nBa(OH)2 = 0,125 mol → Ba2+: 0,125 mol và OH-: 0,25 mol
Dung dịch còn lại có Fe3+: 0,024 mol; Al3+: 0,032 mol; SO42-: 0,088 mol; Cl-: 0,072 mol và H+: 0,08 mol
Khi nhỏ từ từ Ba(OH)2 vào thì
OH- + H+ → H2O
0,08 ← 0,08
Fe3+ + 3OH- → Fe(OH)3
0,024 → 0,072 → 0,072
Al3+ + 3OH- → Al(OH)3
0,032 → 0,096 → 0,032
→ nOH- dư = 0,25 - 0,08 - 0,072 - 0,096 = 0,002 mol → Al(OH)3 hòa tan một phần
OH- + Al(OH)3 → AlO2- + 2H2O
0,002 → 0,002 mol
Ba2+ + SO42- → BaSO4
0,088 ← 0,088 → 0,088
→ Kết tủa tạo ra có 0,024 mol Fe(OH)3; 0,03 mol Al(OH)3 và 0,088 mol BaSO4
→ m = 25,412 gam
Câu 5:
Chọn đáp án B
Phương trình rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch các chất điện li.
Câu 6:
Chọn đáp án C
Phương pháp giải:
Giải chi tiết:
H3PO4 có ứng dụng là bán thành phẩm trong quá trình sản xuất phân bón, dược phẩm, thức ăn gia súc; làm chất xúc tác trong tổng hợp hữu cơ, chất tẩm gỗ chống cháy, chất chống ăn mòn kim loại.
→ H3PO4 không có ứng dụng điều chế đạn khói, đạn cháy
Câu 7:
Chọn đáp án A
A. đúng
B. sai vì phân ure có công thức là (NH2)2CO
C. sai vì amophot là hỗn hợp của NH4H2PO4 và (NH4)2HPO4
D. sai vì phân lân cung cấp nguyên tố P
Câu 8:
Chọn đáp án C
Phương pháp giải:
Giải chi tiết:
- A, B, D đúng
- C sai vì N2 tan rất ít trong nước
Câu 9:
Chọn đáp án C
Nguyên tố A là photpho.
Câu 10:
Chọn đáp án D
Phương pháp giải:
PTHH: C + O2 CO2 → mC
Từ số mol của CO2 ta suy ra số mol của C.
Giải chi tiết:
Ta có: nCO2 = 0,03 mol
C + O2 CO2
0,03 ← 0 03 mol
→ mC = 0,03.12 = 0,36 gam → %mC = (0,36/10).100% = 3,6%
Câu 11:
Chọn đáp án B
- NH3 là chất có tính bazo yếu do khi hòa tan trong nước có cân bằng: NH3 + H2O ⇄ NH4+ + OH-
- Trong NH3, N có số oxi hóa là -3. Đây là số oxi hóa thấp nhất nên NH3 có tính khử
Câu 12:
Chọn đáp án A
Phương pháp giải:
Thuyết Arenius:
+ Axit là chất có khả năng phân li ra ion H+
+ Bazo là chất có khả năng phân li ra ion OH‑
Giải chi tiết:
- A đúng
- B sai vì bazo là chất có khả năng phân li ra ion OH‑ nên bắ buộc phải chứa nhóm OH-
- C sai vì một số chất có chứa H trong phân tử nhưng không có khả năng phân li ra ion H+ nên không phải axit. VD: Na2HPO3
- D sai vì có những chất có chứa nhóm OH nhưng không phải bazo. VD: C2H5OH
Câu 13:
Chọn đáp án D
Phương pháp giải:
Cách xác định hiệu suất tính theo chất nào?
Tương tự như cách xác định chất phản ứng hết.
PTHH: aA + bB → cC + dD
Đề bài cho biết nA và nB. Để biết được hiệu suất tính theo chất nào ta so sánh tỉ số và .
Tỉ số nào nhỏ hơn thì hiệu suất tính theo chất đó.
Giải chi tiết:
PTHH: N2 + 3H2 ⇄ 2NH3
Ban đầu: 0,1 0,4 mol (So sánh thấy: nên hiệu suất tính theo N2 => nN2 pư = 0,1.25% = 0,025 mol)
Pư: 0,025 → 0,075 → 0,05
→ V = 0,05.22,4 = 1,12 lít
Câu 14:
Chọn đáp án C
Phương pháp giải:
Dựa vào phương pháp điều chế HNO3.
Giải chi tiết:
- Để điều chế HNO3 người ta điều chế từ NaNO3 rắn và H2SO4 đặc
- Vì phản ứng xảy ra ở điều kiện đun nóng và HNO3 là chất dễ bay hơi nên để thu được HNO3 lỏng thì ta cần ngưng tụ bằng nước đá.
Câu 15:
Chọn đáp án A
Phương pháp giải:
Tính pH = -log [H+]
Nếu pH < 7 thì dung dịch có MT axit
Nếu pH = 7 thì dung dịch có MT trung tính
Nếu pH > 7 thì dung dịch có MT bazo
Giải chi tiết:
Ta có pH = -log[H+] = -log 10-2 = 2 → dung dịch có môi trường axit.
Câu 16:
Cho các nhận xét sau:
(1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối.
(2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu.
(3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
(4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-.
Số nhận xét đúng là?
Chọn đáp án C
Phương pháp giải:
Giải chi tiết:
(1) đúng
(2) đúng
(3) sai. VD: (NH4)2CO3 là muối điện li ra ion NH4+ không phải là ion kim loại.
(4) sai vì nước cất không dẫn điện
→ Vậy có 2 nhận xét đúng
Câu 17:
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
A. đúng
B. sai vi Si không phản ứng với HCl
C. sai vì Si không phản ứng với Ne
D. sai vì Si không phản ứng với Cu
Câu 18:
Chọn đáp án A
Phương pháp giải:
Từ số mol NaOH và HCl tính được số mol của OH- và H+
Tính theo PT ion: H+ + OH- → H2O
Giải chi tiết:
nOH- = nNaOH = 0,01 mol và nH+ = nHCl = 0,04 mol
PT ion: H+ + OH- → H2O
Bđ: 0,04 0,01
Pư: 0,01 ← 0,01
Sau: 0,03 0
→ [H+] = = 0,1M → pH = -log[H+] = 1
Câu 19:
Chọn đáp án C
Phản ứng Cu + 2AgNO3 → Cu(NO3)2 + 2Ag thuộc loại phản ứng thế, không phải phản ứng trao đổi ion.
Câu 20:
Chọn đáp án D
Phương pháp giải:
200 ml X + BaCl2 có Ba2+ + SO42-→ BaSO4
nBaSO4 → nSO42-
200 ml X + Ba(OH)2 thì Ba2+ + SO42-→ BaSO4
Fe2+ + 2OH- → Fe(OH)2
→ mkết tủa = mBaSO4 + mFe(OH)2 → mFe(OH)2 → mFe(OH)2 → nFe(OH)2 → nFe2+
So sánh số mol Fe2+ và SO42-
Nếu số mol 2 ion bằng nhau thì có muối FeSO4 và muối còn lại AlCl3
Nếu số mol 2 ion khác nhau thì có muối FeCl2 và Al2(SO4)3
Giải chi tiết:
*Cho 200 ml X tác dụng với BaCl2 dư: nBaSO4 = 0,06 mol
Ba2+ + SO42-→ BaSO4
0,06 ← 0,06
*200 ml X tác dụng với Ba(OH)2 dư:
Ba2+ + SO42-→ BaSO4
Fe2+ + 2OH- → Fe(OH)2
→ mkết tủa = mBaSO4 + mFe(OH)2 → 0,06.233 + mFe(OH)2 = 21,18 → mFe(OH)2 = 7,2 gam
→ nFe(OH)2 = 0,08 mol → nFe2+ = 0,08 mol
Vì số mol Fe2+ và số mol SO42- khác nhau nên muối ban đầu cho vào X không có FeSO4
→ 2 muối là FeCl2 và Al2(SO4)3
→ nCl-= 2nFe2+ = 2.0,08 = 0,16 mol → [Cl-] = 0,16 : 0,2 = 0,8M
Câu 21:
Hoàn thành phương trình phản ứng sau, ghi rõ điều kiện phản ứng nếu có.
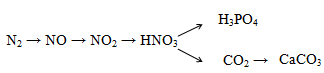
(1) N2 + O2 ⇌ 2NO
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) 5HNO3 đặc + P H3PO4 + 5NO2 + H2O
(5) 2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
(6) CO2 + CaO → CaCO3
Câu 22:
Cho 17,6 gam hỗn hợp X gồm Cu và CuO tác dụng vừa đủ dung dịch HNO3 loãng sinh ra 2,24 lít khí NO (điều kiện tiêu chuẩn, sản phẩm khử duy nhất).
a. Viết phương trình phản ứng?
b. Tính % khối lượng mỗi chất trong hỗn hợp X?
a.
(1) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(2) CuO + 2HNO3 → Cu(NO3)2 + H2O
b.
nNO = 2,24 : 22,4 = 0,1 mol
Từ PTHH (1) => nCu = 3nNO/2 = 0,15 mol
% khối lượng các chất trong X là:
Câu 23:
Cho 5,1 gam hỗn hợp A gồm hai kim loại Mg và Al có tỉ lệ mol 1:1 tác dụng vừa đủ với dung dịch gồm KNO3 và HCl đến khi các phản ứng xảy ra hoàn toàn thu được dung dịch B và hỗn hợp khí có thể tích 3,36 lít (đktc) gồm NO và H2 có tỉ khối của B so với H2 bằng 31/3. Cô cạn cẩn thận dung dịch B thu được m gam muối. Tính giá trị m ?
Phương pháp giải:
- Từ tổng khối lượng hỗn hợp KL và tỉ lệ mol ta tính được số mol từng KL.
- Dựa vào tỉ khối và tổng thể tích của khí ta tính được số mol từng khí.
- Tóm tắt: A + KNO3 + HCl → 0,1 mol NO và 0,05 mol H2
So sánh: ne nhường = 2nMg + 3nAl > n e nhận = 3nNO + 2nH2 nên phản ứng có tạo NH4+
Viết các quá trình cho nhận e tính được mol của NH4+
Vì phản ứng tạo cả H2 nên NO3- hết
+ Bảo toàn N: nKNO3 = nNO + nNH4+
+ Xác định các ion có trong dung dịch sau pư.
BTĐT tính được nCl- = nK+ + 2nMg2+ + 3nAl3+ + nNH4+
→ m = mmuối = mion
Giải chi tiết:
- Đặt số mol của Mg và Al trong A là x mol (vì số mol 2 chất bằng nhau)
→ mA = 24x + 27x = 5,1 → x = 0,1 mol
- Xét hỗn hợp khí NO và H2 có số mol lần lượt là a và b mol
Ta có: nhh = a + b = 0,15 mol (1)
mhh = Mhh.nhh => 30a + 2b = 31/3.2.0,15 = 3,1 (2)
Giải (1) và (2) có a = 0,1 mol và b = 0,05 mol
- Tóm tắt: A + KNO3 + HCl → 0,1 mol NO và 0,05 mol H2
QT nhường electron:
Mg → Mg+2 + 2e
Al → Al+3 + 3e
QT nhận electron:
N+5+5 + 3e → N+2
2H+ + 2e → H2
Ta có:
ne nhường = 2nMg + 3nAl = 0,1.2 + 0,1.3 = 0,5 mol
n e nhận = 3nNO + 2nH2 = 0,1.3 + 0,05.2 = 0,4 mol
=> n e nhường > n e nhận => Sản phẩm khử của NO3- còn có NH4+
QT nhường electron:
Mg → Mg+2 + 2e
Al → Al+3 + 3e
QT nhận electron:
N+5+5 + 3e → N+2
2H+ + 2e → H2
N+5+5 + 8e → N-3 (NH4+)
→ nNH4+ = (0,5 - 0,4) : 8 = 0,0125 mol
Vì phản ứng tạo cả H2 nên NO3- hết
Bảo toàn N: nKNO3 = nNO + nNH4+ = 0,1 + 0,0125 = 0,1125 mol
→ Dung dịch muối gồm có
BTĐT: nCl- = nK+ + 2nMg2+ + 3nAl3+ + nNH4+ = 0,625 mol
→ m = mmuối = mion = 31,9 gam
Câu 24:
Hấp thụ hoàn toàn 5,6 lít CO2 (điều kiện tiêu chuẩn) bằng 200 ml dung dịch NaOH 2M thu được m gam muối. Tính giá trị m?
Phương pháp giải:
Lập tỉ lệ nNaOH : nCO2 = a Nếu a ≤ 1 → chỉ tạo NaHCO3 Nếu 1 < a < 2 thì phản ứng tạo 2 muối Nếu a ≥ 2 thì phản ứng chỉ tạo Na2CO3 PTHH: NaOH + CO2 → NaHCO3 2NaOH + CO2 → Na2CO3
Giải chi tiết:
nCO2 = 0,25 mol; nNaOH = 0,4 mol
vì nNaOH : nCO2 = 0,4 : 0,25 = 1,6 nên phản ứng tạo 2 muối Na2CO3 và NaHCO3
PTHH:
NaOH + CO2 → NaHCO3
x x x
2NaOH + CO2 → Na2CO3
2y y y
Ta có hệ phương trình:
→ m = mNa2CO3 + mNaHCO3 = 0,1.84 + 0,15.106 = 24,3 gam
Câu 25:
Nhiệt độ trong nhà kính luôn cao hơn nhiệt độ bên ngoài vì ánh sáng mặt trời khi chiếu vào nhà kính thì một phần năng lượng bức xạ của ánh sáng bị hấp thụ và phân tán trở lại thành nhiệt lượng. Hiện tượng này gọi là hiệu ứng nhà kính. CO2 trong khí quyển cũng giống như một tầng kính dày bao phủ Trái đất, làm cho Trái đất giống như một nhà kính lớn. Theo tính toán, nếu không có tầng khí quyển, nhiệt độ bề mặt Trái đất là -230C, nhưng nhiệt độ trung bình thực tế là 150C, có nghĩa là ‘’hiệu ứng nhà kính’’ đã làm cho Trái đất nóng lên 380C Khi lượng CO2 càng tăng thì hiệu ứng nhà kính cũng tăng theo không ngừng. Trong vòng 200 năm qua, lượng khí CO2 đã tăng thêm 25% và nhiệt độ trung bình của Trái đất tăng thêm 0,50C. Theo ước tính, đến giữa thế kỉ sau, nhiệt độ Trái đất sẽ tăng thêm khoảng 1,5 - 4,50C, kéo theo nhiều hậu quả nghiêm trọng.
- Theo em, hiệu ứng nhà kính có ảnh hưởng tốt hay không tốt đối với môi trường sống của con người? Vì sao?
Phương pháp giải:
- Hiệu ứng nhà kính có cả ảnh hưởng tốt và không tốt đến môi trường sống của con người → chú ý cả mặt tốt và mặt xấu của hiệu ứng nhà kính
Giải chi tiết:
- Hiệu ứng nhà kính vừa có ảnh hưởng tốt và không tốt đối với môi trường sống của con người:
+) Tác động tốt: Nhờ lớp khí quyển gây hiệu ứng nhà kính nên nhiệt độ trái đất là 15oC chứ không phải -23oC nên sinh vật và con người mới sống được.
+) Tác động không tốt: Khi lượng khí CO2 càng tăng → Hiệu ứng nhà kính càng tăng → Nhiệt độ trái đất ngày càng tăng → Gây khó khăn cho sinh vật và con người.
Hơn nữa nhiệt độ tăng làm cho hiện tượng băng tan → thu hẹp dần diện tích đất sinh sống của con người, gây ngập lụt thiên tai ở nhiều nơi.
Câu 26:
- Hãy kể tên ít nhất hai chất khí là nguyên nhân chủ yếu gây hiệu ứng nhà kính mà em biết?
Phương pháp giải:
- Các chất khí gây hiệu ứng nhà kính em biết: xem lại SGK
Giải chi tiết:
- Một số chất khí là nguyên nhân chủ yếu gây hiệu ứng nhà kính: CO2, CH4, CFC, O3, NO2
