Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 7)
-
4710 lượt thi
-
8 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
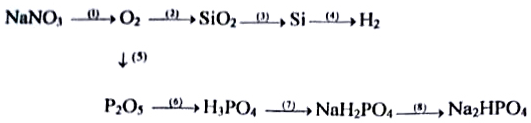
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
Câu 2:
Phân biệt các dung dịch sau (không dùng quỳ tím):
Na2CO3, NH4Cl, Na2SiO3, Na3PO4
Phương pháp giải:
- Sử dụng dung dịch NaOH, nhận biết được dung dịch NH4Cl
- Sử dụng axit HCl nhận biết được các chất còn lại
Giải chi tiết:
- Trích các mẫu nhận biết vào các ống nghiệm.
- Nhỏ vài giọt dung dịch NaOH vào các ống nghiệm
+ Xuất hiện khí không màu, mùi khai: NH4Cl
+ Không có hiện tượng: Na2CO3, Na2SiO3, Na3PO4
PTHH:
- Nhỏ vài giọt dung dịch HCl vào các ống nghiệm chưa được nhận biết
+ Có khí không màu thoát ra: Na2CO3
+ Xuất hiện kết tủa keo: Na2SiO3
+ Không có hiện tượng: Na3PO4
PTHH:
Câu 3:
Giải thích vì sao không dùng bình chữa cháy chứa khí CO2 để dập tắc các đám cháy than hay kim loại đứng trước Zn?
Phương pháp giải:
Kim loại có tính khử mạnh như Mg, Al,… có thể cháy được trong khí CO2.
Giải chi tiết:
Kim loại có tính khử mạnh (thí dụ Mg, Al,…) có thể cháy được trong khí CO2:
Vì vậy, người ta không dùng khí CO2 để dập tắt đám cháy magie hoặc nhôm.
Câu 4:
Phương pháp giải:
Trong thực tế, người ta thường dùng muối NH4HCO3 để làm xốp bánh.
Giải chi tiết:
Các muối amoni cacbonat và amoni hiđrocacbonat bị phân hủy dần dần ngay ở nhiệt độ thường giải phóng khí NH3 và khí CO2, khi đun nóng phản ứng xảy ra nhanh hơn
Trong thực tế, người ta thường dùng muối NH4HCO3 để làm xốp bánh.
Câu 5:
Phương pháp giải:
- Tính số mol CO2 và Ca(OH)2
- Xét tỷ lệ và kết luận muối sinh ra
- Viết PTHH, đặt ẩn
- Lập phương trình số mol CO2 (*)
- Lập phương trình số mol Ca(OH)2 (**)
- Từ (*) và (**) tìm ra số mol mỗi muối
- Tính khối lượng dung dịch sau phản ứng
- Tính nồng độ phần trăm muối tan trong dung dịch.
Giải chi tiết:
Ta có: phản ứng tạo 2 muối và
(1)
2x ← x → x
(2)
y ← y → y
Gọi số mol của Ca(OH)2 trong phương trình (1) và (2) lần lượt là x và y
→ x + y = 0,15 (*)
Theo phương trình (1) và (2) ta có số mol CO2 lần lượt là 2x và y mol
→ 2x + y = 0,25 (**)
Từ (*) và (**) → x = 0,1 và y = 0,05
Ta có: mdd spu =
Câu 6:
Metyl salixylat là hợp chất được dùng làm thuốc xoa bóp giảm đau. Oxi hóa hoàn toàn 7,6 gam metyl salixylat rồi dẫn sản phẩm lần lượt qua bình H2SO4 đặc (1) và bình nước vôi trong (2) thấy bình (1) tăng 3,6 gam, bình (2) tăng 17,6 gam. Tìm công thức đơn giản nhất của metyl salixylat.
Phương pháp giải:
- Khối lượng bình 1 tăng chính là khối lượng của nước, suy ra số mol nước và số mol H - Khối lượng bình 2 tăng là khối lượng của CO2, suy ra số mol CO2 và số mol C - Tính tổng khối lượng C và H, so sánh với khối lượng của metyl salixylat, kết luận có O hay không - Gọi công thức phân tử của metyl salixylat là CxHyOz - Kết luận
Giải chi tiết:
Ta có: mbình 1 tăng = mnước
Ta có: mbình 2 tăng = mCO2
Vì mC + mH = 4,8 + 0,4 = 5,2 < mmetyl salixylat → trong metyl salixylat có O
Gọi công thức phân tử của metyl salixylat là CxHyOz
Vậy công thức đơn giản nhất của metyl salixylat là C8H8O3.
Câu 7:
Xác định công thức phân tử biết khi hóa hơi 11,4 gam metyl salixylat thì thu được thể tích đúng bằng thể tích của 2,4 gam khí oxi (đo cùng điều kiện).
Phương pháp giải:
- Tính số mol O2
- Vì thể tích của metyl salixylat bằng thể tích của oxi nên số mol của chúng bằng nhau - Tính phân tử khối của metyl salixylat
- Kết luận.
Giải chi tiết:
Vì thể tích của metyl salixylat bằng thể tích oxi nên
Vậy công thức phân tử của metyl salixylat là C8H8O3.
Câu 8:
Nung 37,6 gam Cu(NO3)2 một thời gian thu được 26,8 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn hỗn hợp X vào 500 ml nước thu được dung dịch Y. Tính pH của dung dịch Y.
Phương pháp giải:
- Gọi số mol O2 là x, suy ra số mol của NO2 theo số mol O2
- Áp dụng bảo toàn khối lượng, tìm ra số mol O2
- Viết phương trình phản ứng của hỗn hợp X với nước
- Tính số mol HNO3 theo số mol O2
- Tính số mol H+
- Tính nồng độ H+
- Tính pH của dung dịch thu được.
Giải chi tiết:
PTHH:
Gọi số mol O2 là x → số mol của NO2 là 4x
Áp dụng bảo toàn khối lượng cho phản ứng:
Dẫn hỗn hợp khí X vào nước ta có phương trình:
Theo phương trình,
