Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 23)
-
4720 lượt thi
-
13 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chọn đáp án D
C2H5OH khi tan trong nước không phân li ra ion.
Câu 2:
Chọn đáp án B
Phương pháp giải:
Dựa vào khái niệm chất điện li mạnh: Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion.
Giải chi tiết:
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion (tức α=1).
Câu 3:
Chọn đáp án A
Phương pháp giải:
Tính pH của dung dịch: pH = -log[H+]
+ pH < 7 => môi trường axit
+ pH = 7 => môi trường trung tính
+ pH > 7 => môi trường bazo
Chú ý: Không có môi trường lưỡng tính.
Giải chi tiết:
pH = -log[H+] = -log(5.10-4) = 3,3
Ta thấy pH < 7 nên dung dịch X có môi trường axit
Câu 4:
Chọn đáp án D
Do phân tử N2 có chứa liên kết 3 rất bền vững, không phân cực và có năng lượng lớn nên N2 tương đối trơ về mặt hóa học ở điều kiện thường.
Câu 5:
Chọn đáp án A
Phương pháp giải:
Dựa vào phương pháp nhận biết ion PO43- bằng phương pháp hóa học.
Giải chi tiết:
Ta dùng ion Ag+ để nhận biết ion PO43- do tạo kết tủa màu vàng:
Ag+ + PO43- → Ag3PO4 ↓ vàng
Câu 6:
Chọn đáp án B
Phương pháp giải:
- Supephotphat đơn: Ca(H2PO4)2 và CaSO4
- Supephotphat kép: Ca(H2PO4)2
Giải chi tiết:
Thành phần hóa học chính của phân lân supephotphat kép là Ca(H2PO4)2.
Câu 7:
Chọn đáp án D
Ure (NH2)2CO là phân bón có thành phần N lớn nhất.
Câu 8:
Chọn đáp án B
Phương pháp giải:
Tính tỉ lệ
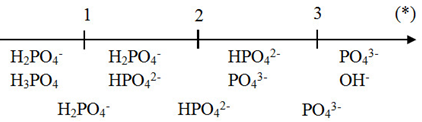
Giải chi tiết:
=> Muối Na2HPO4
Câu 9:
Chọn đáp án A
Phương pháp giải:
Dung dịch có môi trường axit làm quỳ tím chuyển đỏ.
Cách đánh giá môi trường của một dung dịch muối:
- Muối được tạo từ axit mạnh + bazo mạnh => Môi trường trung tính
- Muối được tạo bởi axit mạnh + bazo yếu => Môi trường axit
- Muối được tạo bởi axit yếu + bazo mạnh => Mối trường bazo
Chú ý: Không có môi trường lưỡng tính
Giải chi tiết:
NH4Cl được tạo bởi bazo yếu (NH3) và axit mạnh HCl nên có môi trường axit => làm quỳ tím chuyển đỏ.
Câu 10:
Chọn đáp án A
Phương pháp giải:
Nắm được phản ứng nhiệt phân các muối nitrat của KL:
- Muối của KL kiềm (K, Na, …), kiềm thổ (Ca, Ba, …) phân hủy thành muối nitrit + O2.
- Muối của Mg, Zn, Fe, ..., Cu phân hủy thành oxit kim loại + NO2 + O2.
- Muối của các kim loại Ag, Au, Hg, … bị phân hủy thành các kim loại tương ứng + NO2 + O2.
Giải chi tiết:
2AgNO3 2Ag + 2NO2 + O2
Câu 11:
Trộn 500 ml dung dịch HNO3 0,02M với 500 ml dung dịch NaOH 0,04M thu được dung dịch X. Tính pH của dung dịch X.
Phương pháp giải:
- Tính nH+; nOH-
- Viết PTHH dưới dạng ion
- Tính toán theo PTHH
- Tính pH của dung dịch thu được sau phản ứng
Giải chi tiết:
nH+ = nHNO3 = 0,02.0,5 = 0,01 mol
nOH- = nNaOH = 0,04.0,5 = 0,02 mol
H+ + OH- → H2O
Bđ: 0,01 0,02 (mol)
Pư: 0,01→0,01 (mol)
Sau: 0 0,01 (mol)
[OH-] = n/V = 0,01/(0,5 + 0,5) = 0,01M
=> pOH = -log[OH-] = -log(0,01) = 2
=> pH = 14 – pOH = 14 – 2 = 12
Vậy pH của dung dịch thu được sau phản ứng là 12.
Câu 12:
Hòa tan hoàn toàn 3,04 gam hỗn hợp X gồm (Fe, Cu) tác dụng hoàn toàn với dung dịch HNO3 loãng dư, sau phản ứng thu được 0,896 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối lượng mỗi kim loại trong hỗn hợp X?
Phương pháp giải:
Cách 1: Viết và tính toán theo PTHH:
Đặt ẩn là số mol của Fe và Cu. Dựa vào dữ kiện đề bài để lập hệ phương trình.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cách 2: Sử dụng định luật bảo toàn electron:
Đặt ẩn là số mol của Fe và Cu. Dựa vào dữ kiện đề bài để lập hệ phương trình.
Giải chi tiết:
nNO = 0,896/22,4 = 0,04 mol
Cách 1: Viết và tính toán theo PTHH
Đặt x, y lần lượt là số mol của Fe và Cu
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
x → x (mol)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
y → 2y/3 (mol)
- Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1)
- Số mol khí NO thu được: nNO = x + 2y/3 = 0,04 (2)
Giải (1) và (2) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Cách 2: Sử dụng định luật bảo toàn electron:
- Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1’)
- Định luật bảo toàn e: 3nFe + 2nCu = 3nNO => 3x + 2y = 3.0,04 (2’)
Giải (1’) và (2’) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Câu 13:
Phản ứng của thuốc nổ đen: 2KNO3 + 3C + S 3CO2 + N2 + K2S; ΔH < 0
Tính phần trăm theo khối lượng các chất trong thuốc nổ đen, biết rằng thuốc nổ đen được trộn theo đúng tỉ lệ phản ứng. Khi đốt 1 kg thuốc nổ đen có thể tạo thành khối khí có thể tích bao nhiêu (ở 2730C và 1 atm).
Phương pháp giải:
Tính toán theo PTHH.
Giải chi tiết:
Hỗn hợp thuốc nổ đen gồm KNO3, C, S với tỉ lệ mol tương ứng là 2 : 3 : 1.
* Tính phần trăm theo khối lượng các chất trong thuốc nổ đen:
*Tính thể tích khí sinh ra khi đốt 1 kg thuốc nổ đen:
Thể tích khí thu được ở 273oC và p = 1 atm:
