Trắc nghiệm chuyên đề Hóa 12 Chủ đề 5: Kim loại tác dụng với dung dịch axit có đáp án
Trắc nghiệm chuyên đề Hóa 12 Chủ đề 5: Kim loại tác dụng với dung dịch axit có đáp án
-
366 lượt thi
-
11 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hòa tan 4,59 gam nhôm trong dung dịch HNO3 1M thu được hỗn hợp X gồm hai khí NO và N2O, tỉ khối hơi của X đối với hidro bằng 16,75. Tính :
a) Thể tích mỗi khí đo ở đktc.
b) Khối lượng muối thu đươc.
c) Thể tích dung dịch HNO3 đã dùng.
Áp dụng phương pháp sơ đồ chéo:

Gọi nN2O = x (mol) và nNO = 3x (mol)

Áp dụng bảo toàn số mol electron: 17x = 0,51 ⇒ x = 0,03 (mol)
⇒ nNO = 0,09 (mol); nN2O = 0,03 (mol)
a) VNO = 0,09.22,4 = 2,016 (lít); VN2O = 0,03.22,4 = 0,672 (lit)
nHNO3 = nHNO3 bị khử + nHNO3 tham gia tạo muối = 5x + 3.nAl = 0,03 + 3.0,17 = 0,66(mol)
b) mmuối = n_Al.M = 0,17.213 = 36,21 (gam)
c) VHNO3 đã dùng = 0,66/1 = 0,66 (lít)
Câu 2:
Cho 11 gam hỗn hợp Al và Fe vào dung dịch HNO3 loãng lấy dư thì có 6,72 lít khí NO bay ra (đktc). Tính khối lượng của mỗi kim loại trong hỗn hợp.
Gọi số mol Al và Fe trong hỗn hợp là x, y (mol)
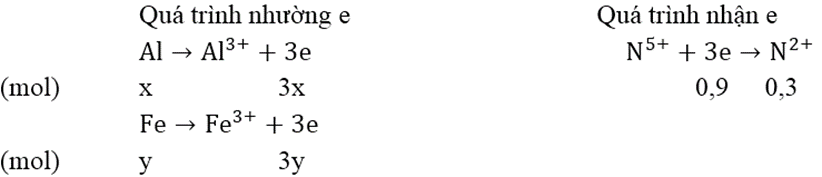
Bảo toàn electron: 3x + 3y = 0,9 ⇒ x + y = 0,3 (1)
mhỗn hợp = 27x + 56y = 11 (2)
Giải hệ phương trình (1) và (2): x = 0,2 (mol); y = 0,1 (mol)
Vậy mAl = 5,4 (gam) và mFe = 5,6 (gam)
Câu 3:
Cho 3,87 gam hỗn hợp A gồm Mg và Al vào 250 ml dung dịch X chứa axit HCl 1M và H2SO4 0,5M được dung dịch B và 4,368 lít H2 (đktc)
a) Tính phần trăm khối lượng kim loại trong A.
b) Tính thể tích dung dịch C gồm NaOH 0,2M và Ba(OH)2 0,1M cần để trung hòa hết lượng axit dư trong B.
a) Đối với bài tập có hỗn hợp axit, bazo giải theo phương trình ôn
nHCl = 0,25 (mol) ; nH2SO4 = 0,125 (mol); nH2 = 0,195 (mol)
= nH+ = 0,25 + 2.0,125 = 0,5 (mol);
nH2.2 < nH+ ⇒ H+ dư
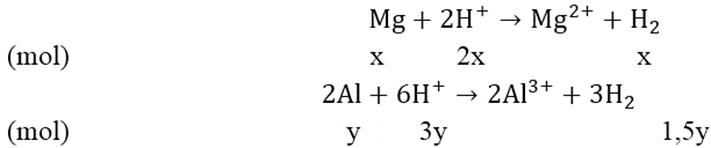
Theo đề bài, ta có hệ phương trình:
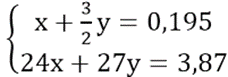
Giải hệ phương trình ta được: x = 0,06 và y = 0,09
⇒ mMg = 1,44 (gam); mAl = 2,43(gam)
b) Gọi thể tích dung dịch C cần dùng là V (lít)
Ta có: nNaOH = 0,02V(mol); nBa(OH)2 = 0,11V (mol)
⇒ n-OH = 0,2 + 0,2 = 0,4V(mol)
nH+dư = 0,5 - (2x + 3y) = 0,11 (mol)
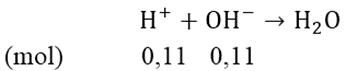
⇒ 0,11 = 0,4V ⇒ V = 0,275 (lít)
Câu 4:
Cho 7,8 gam hỗn hợp Mg, Al tác dụng hết với dung dịch HCl dư sau phản ứng thấy khối lượng dung dịch tăng thêm 7 gam. Tính số mol HCl đã tham gia phản ứng.
Đáp án: A
Nhận xét: Kim loại + HCl → muối + H2
Ta có: mdung dịch tăng = mkim loại – mkhí thoát ra
⇒ mH2 = 7,8 - 7 = 0,8 (gam) ⇒ nH2 = 0,4 (mol)
Áp dụng bảo toàn nguyên tử H: nHCl = 2.nH2 = 0,8 (mol).Câu 5:
Cho 10 gam hỗn hợp gồm Al và kim loại M đứng trước hidro trong dãy điện hóa vào 100 ml dung dịch hỗn hợp H2SO4 aM và HCl 3aM thì thu được 5,6 lít khí H2 (đktc), dung dịch X và phần kim loại chưa tan hết có khối lượng 1,7 gam. Cô cạn X thu được m gam muối. xác định giá trị m.
Đáp án: B
mmuối = mkim loại phản úng + mgốc axit = 8,3 + 96.0,1 + 35,5.0,3 = 28,55(gam)
Câu 6:
Hỗn hợp bột gồm 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần đêu nhau. Phần 1 đem đốt cháy hoàn toàn trong oxi dư thu được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 (sản phẩm khử duy nhất). Hãy tính giá trị của V.
Đáp án: A
Áp dụng định luật bảo toàn khối lượng đối với phần 1 ta có:
mO2 = 8,71 - 7,18/2 = 5,12(g) ⇒ nO2 = 5,12/32 = 0,16(mol)
Do khối lượng kim loại ở hai phần bằng nhau nên số mol do hỗn hợp kim loại nhường là như nhau ⇒ số mol eletron do O2 nhận bằng số mol eletron do N5+ nhận.
⇒ nNO2 = 4nO2 = 0,64 ⇒ VNO2 = 0,64.22,4 = 14,336 (lít)
Câu 7:
Đáp án: D
Ta có: nHNO3 = 0,5.0,1 = 0,05(mol) ⇒ nHNO3 còn = 0,01(mol)
⇒ nHNO3 phản ứng = 0,04(mol)
Các quá trình:

Áp dụng định luật bảo toàn electron ta có:
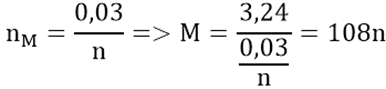
Nghiệm phù hợp: n = 1; M = 108 (Ag)
Câu 8:
Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng dư thu được dung dịch X và 0,448 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là:
Đáp án: C
Ta có: nZn = 13/65 = 0,2 mol và nN2 = 0,448/22,4 = 0,02 mol
ne nhường = 2.nZn = 0,4 mol > ne nhận = 10.nN2 = 0,2 mol → phản ứng tạo thành NH4NO3.
nNH4NO3 = (0,4 - 0,2)/8 = 0,025 mol (vì khi tạo thành NH4NO3: N + 8e → N)
Khối lượng muối trong dung dịch X là = 180.0,2 + 80.0,025 = 39,80 gam
Lưu ý: Đề bài không nói thu được khí X duy nhất nên có thể có muối NH4NO3 tạo thành.
Câu 9:
Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc nóng thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 (dư) vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phần trăm khối lượng của Cu trong hỗn hợp X và giá trị của m lần lượt là:
Đáp án: B
Ta có: nNO2 = 1,344/22,4 = 0,06 mol; gọi nCu = x mol; nAl = y mol
Quá trình nhường e:
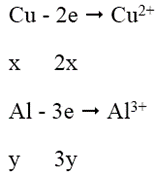
Quá trình nhận e:
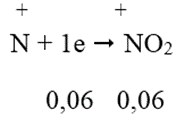
Áp dụng định luật bảo toàn e ta có hệ:
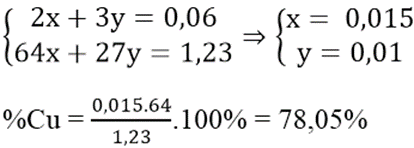
Câu 10:
Hòa tan 4,76 gam hỗn hợp Zn, Al có tỉ lệ mol 1:2 trong 400ml dung dịch HNO3 1M vừa đủ, được dung dịch X chứa m gam muối khan và thấy có khí thoát ra. Giá trị của m là:
Đáp án: C
Ta có: nZn = 0,04 mol; nAl = 0,08 mol
Do phản ứng không tạo khí nên trong dung dịch tạo NH4NO3. Trong dung dịch có: 0,04 mol Zn(NO3)2 và 0,08 mol Al(NO3)3.
Vậy số mol NO3- còn lại để tạo NH4NO3 là:
0,4 - 0,04.2 - 0,08.3 = 0,08 mol
Do đó trong dung dịch tạo 0,04 mol NH4NO3
m = 0,04.189 + 0,08.213 + 0,04.80 = 27,8 gam
Câu 11:
Hòa tan 14,8 gam hỗn hợp gồm Fe và Cu vào lượng dư dung dịch hỗn hợp HNO3 và H2SO4 đặc nóng. Sau phản ứng thu được 10,08 lít NO2 (đktc) và 2,24 lít SO2 (đktc). Khối lượng Fe trong hỗn hợp ban đầu là:
Đáp án: B
Gọi a, b lần lượt là số mol của Fe, Cu
56a + 64b = 14,8 (1)
- Quá trình nhường electron:
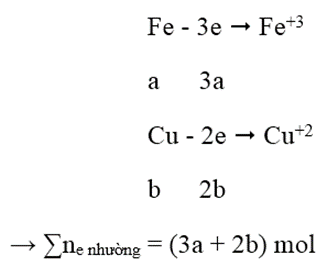
- Quá trình nhận electron:
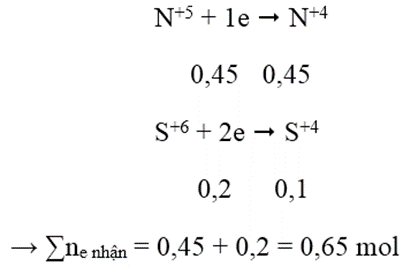
Áp dụng định luật bảo toàn electron:
3a + 2b = 0,65 → a = 0,15 và b = 0,1 → mFe = 8,4 g
