Trắc nghiệm chuyên đề Hóa 12 Chủ đề 7: Ôn tập và kiểm tra chuyên đề sắt và một số kim loại quan trọng (Có đáp án)
Bài tập rèn luyện
-
462 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là:
Fe + S ⇒ M: Fe, S, FeS -+ HCl→ Fe2+, X: H2S, H2; G: S -+ O2→ H2O, SO2
Có 3 chất thay đổi số oxi hóa là Fe, S và Oxi
Bảo toàn e: 4nO2 = 2nFe + 4nSO2 = 2. 0,1 + 4. 0,75 = 0,5 mol
⇒ nO2 = 0,125 mol ⇒ V = 2,8lít
→ Đáp án A
Câu 2:
Một oxit sắt có khối lượng 25,52 gam. Để hòa tan hết lượng oxit sắt này cần dùng vừa đủ 220 ml dung dịch H2SO4 2M (loãng). Công thức của oxit sắt này là:
25,52 gam FexOy + 0,44 mol H2SO4.
Giả sử oxit sắt gồm FeO a mol và Fe2O3 b mol.
FeO + H2SO4 → FeSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Lập hpt
→ Oxit sắt là Fe3O4 (Fe3O4 = FeO.Fe2O3)
→ Đáp án A
Câu 3:
Hỗn hợp bột X gồm Cu, Zn. Đốt cháy hoàn toàn m gam X trong oxi (dư), thu được 40,3 gam hỗn hợp gồm CuO và ZnO. Mặt khác, nếu cho 0,25 mol X phản ứng với một lượng dư dung dịch KOH loãng nóng, thì thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Cu trong X là:
nZn = nH2 = 0,15 ⇒ nCu = 0,1 mol
⇒ %Cu = 0,1. 64 /(0,1. 64 + 0,15. 65) = 39,63%
→ Đáp án C
Câu 4:
Cho m (g) Fe vào dung dịch chứa 1,38 mol HNO3, đun nóng đến kết thúc phản ứng còn 0,75m (g) chất rắn không tan và có 0,38 mol hỗn hợp khí NO, NO2 thoát ra ở (dktc). Giá trị của m là:
Sau phản ứng Fe dư nên chỉ tạo muồi Fe(NO3)2.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Áp dụng sự bảo toàn khối lượng (số mol) N ta có:
nN (trong HNO3) = nN trong Fe(NO3)2 + nN trong NO, NO2
Hay: 1,28 = 2. nFe(NO3)2 + 0,38
⇒ nFe(NO3)2 = 0,5 mol = nFe phản ứng
Vậy: mFe = 0,5.56 = m - 0,75m → m = 112 (g)
→ Đáp án D
Câu 5:
Cho 0,1 mol FeCl3 vào dung dịch Na2CO3 có dư, độ giảm khối lượng dung dịch là:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
nFe(OH)3 = 0,1 mol; nCO2 = 0,1 x 3/2 = 0,15 mol.
Độ giảm khối lượng dung dịch = mFe(OH)3 + mCO2 = 0,1 x 107 + 0,15 x 44 = 17,3 gam
→ Đáp án C
Câu 6:
Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
Phương trình phản ứng:
Fe (a) + CuSO4 → FeSO4 + Cu (a)
mtăng = (64 - 56).a = 1 ⇒ a = 0,125 mol
nFe = 0,125 ⇒ nCu = (15 - 56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
%mFe = [(0,125x56)/15] x 100% = 46,67% ⇒ %mCu = 53,33%
→ Đáp án B
Câu 7:
Cho 0,01 mol Fe vào 50ml dung dịch AgNO3 1M khi phản ứng kết thúc khối lượng AgNO3 thu được là:
nAg+ = 0,05. 1 = 0,05 mol
⇒ nAg+ dư ⇒ nAg = 0,03 mol
⇒ mAg = 3,24g
→ Đáp án B
Câu 8:
Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn dung dịch Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
Xem Fe3O4 là FeO.Fe2O3
Ta có: nFeCl2 = 7,62/127 = 0,06 (mol)
FeO (0,06) + 2HCl → FeCl2 (0,06) + H2O
nFe2O3 = (9,12 - 0,06.72)/160 = 0,03 mol
Fe2O3 (0,03) + 6HCl → 2FeCl3 (0,06) + 3H2O
mFeCl3 = 0,06. 162,5 = 9,75 (g)
→ Đáp án A
Câu 9:
Cho luồng khí CO đi qua ống sứ đựng m gam Fe2O3 ở nhiệt độ cao một thời gian, người ta thu được 6,72 gam hỗn hợp gồm 4 chất rắn khác nhau. Đem hòa tan hoàn toàn hỗn hợp rắn này vào dung dịch HNO3 dư tạo thành 0,448 lít khí NO (đktc). Giá trị của m là
CO + m gam Fe2O3 -to→ 6,72 gam hỗn hợp gồm 4 chất rắn khác nhau.
m gam hỗn hợp + HNO3 dư → 0,02 mol NO.
Bản chất của phản ứng là quá trình nhường nhận electron:
C+2 → C+4 + 2e
N+5 + 3e → N+2
Theo bảo toàn electron 2 x nCO = 3 x nNO → nCO = 3 x 0,02 : 2 = 0,03 mol.
CO + Fe2O3 → 6,72 gam hỗn hợp + CO2
nCO2 = nCO = 0,03 mol.
Theo bảo toàn khối lượng:
mFe2O3 = mhỗn hợp + mCO2 - mCO = 6,72 + 0,03 x 44 - 0,03 x 28 = 7,2 gam
→ Đáp án C
Câu 10:
Ngâm một kim loại có khối lượng 50 gam trong dung dịch HCl, sau một thời gian thu dược 4,368 lit khí H2 (đktc) và khối lượng kim loại giảm 3,51 gam. Kim loại đã dùng là:
Bảng biện luận:
|
n |
1 |
2 |
3 |
|
M |
9 |
18 |
27 |
Vậy kim loại M là nhôm (Al)
→ Đáp án B
Câu 11:
Cho bột Cu dư vào 2 cốc đựng V1 (lít) dung dịch HNO3 4M và V2 (lít) dung dịch hỗn hợp HNO3 3M và H2SO4 1M đều thu được V lít (đktc) khí NO duy nhất thoát ra. Mối quan hệ giữa V1 và V2 là
nH+ (1) = nH+(2) ⇒ 4V1 = V2 (3 + 1.2) ⇒ V1 = 1,25V2
→ Đáp án D
Câu 12:
nFe phản ứng = (16,8 – 8,4)/56 = 0,15 mol
Vì kim loại dư nên chỉ tạo thành muối sắt II
→ Tổng số mol Fe phản ứng: 3/2x = 0,15 → x = 0,1 mol
→ Thể tích khí thu được: 2,24 lít
→ Đáp án A
Câu 13:
Hòa tan hết m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 bằng HNO3 đặc nóng thu được 4,48 lít khí NO (đktc). Cô cạn dung dịch sau phản ứng thu được 145,2 gam muối khan. Giá trị của m là
X(FeO, Fe2O3, Fe3O4) -+HNO3→ 0,2 mol NO + Fe(NO3)3
Khối lượng muối thu được chỉ chứa Fe(NO3)3 → nFe(NO3)3 = 145,2 : 242 = 0,6 mol
Coi hỗn hợp X chứa Fe: 0,6 mol và O: x mol
Bảo toàn electron: 0,6 x 3 = 2x + 0,2 x 3 → x = 0,6 mol
→ m = mFe + mO = 0,6 x 56 + 0,6 x 16 = 43,2 gam
→ Đáp án C
Câu 14:
Hòa tan m(g) hỗn hợp Fe và Cu, trong đó Fe chiếm 40% khối lượng bằng dung dịch HNO3 thu được dung dịch X; 0,448 lít NO duy nhất (đktc) và còn lại 0,65m (g) kim loại. Khối lượng muối trong dung dịch X là:
Ta có: mFe = 40%. m = 0,4m (g) → mCu = m - 0,4m = 0,6m (g)
Sau phản ứng còn 0,65m (g) kim loại > mCu = 0,6m (g)
→ Khối lượng Fe còn dư: 0,65m - 0,6m = 0,05m (g)
Vậy: mFe phản ứng = 0,4m - 0,05m = 0,35m (g)
Do Fe còn dư sau phản ứng nên tạo thành muối Fe2+.
- Quá trình nhường electron:
- Quá trình nhận electron:
Áp dụng định luật bảo toàn electron, ta có:
![]()
Ta có:
![]()
⇒ mFe(NO3)2 = 0,03. 180 = 5,4 (g)
→ Đáp án A
Câu 15:
Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x : y = 2 : 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hòa tan là:
Do H2SO4 chưa biết nồng độ nên xét 2 trường hợp:
∗ Trường Hợp 1: H2SO4 loãng:
⇒ loại vì x = y
∗ Trường Hợp 2: H2SO4 đặc nóng
Ta có:
![]()
Do Fe dư nên tiếp tục xảy ra phản ứng:
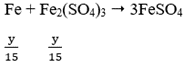
![]()
Vậy Fe hết
Cuối cùng: Fe → Fe2+ nên ta có:
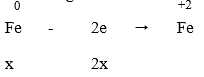
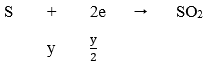
Áp dụng định luật bảo toàn electron ta có: 2x = y
→ Đáp án B
Câu 16:
Khử m gam Fe3O4 bằng khí H2 thu được hỗn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
Hướng dẫn giải:
m gam Fe3O4 + H2 → hỗn hợp X gồm Fe, FeO.
hỗn hợp X + 0,6 mol H2SO4.
Ta có Fe + 2H+ → Fe2+ + H2↑; FeO + 2H+ → Fe2+ + H2O
nFe + nFeO = nH+ : 2 = 0,6 x 2 : 2 = 0,6 mol → nFe3O4 = 1/3 x (nFe + nFeO) = 1/3 x 0,6 = 0,2 mol
→ mFe3O4 = 0,2 x 232 = 46,4 gam
→ Đáp án D
Câu 17:
Hoà tan 3,24 gam Ag bằng V ml dung dịch HNO3 0,7M thu được khí NO duy nhất và V ml dung dịch X trong đó nồng độ mol của HNO3 dư bằng nồng độ mol của AgNO3. Giá trị của V là:
0,03 mol Ag + V ml AgNO3 0,7M → NO↑
CM AgNO3 = CM HNO3 dư
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
nHNO3 phản ứng = 0,03 : 3 x 4 = 0,04 mol.
Vì V không thay đổi nên nHNO3 dư = nAgNO3 = 0,03 mol
→ ∑nHNO3 = 0,04 + 0,03 = 0,07 mol
→ VHNO3 = 0,07 : 0,7 = 0,1 lít = 100 ml
→ Đáp án B
Câu 18:
Cho 19,2 gam một kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 4,48 lít khí duy nhất No (đktc). Kim loại M là kim loại nào sau đây:
Số mol NO là nNO = 4,48/22,4 = 0,2 mol
3M (0,6/n) + 4nHNO3 → 3M(NO3)n + nNO (0,2) + 2nH2O
M = 19,2:(0,6/n) = 32n → n = 2; M = 64 → M: Cu
→ Đáp án B
Câu 19:
Cho 23,52 gam hỗn hợp X gồm Mg, Fe, Cu vào 200ml dung dịch HNO3 3,4M. Khuấy đều thấy thoát ra khí NO (sản phẩm khử duy nhất), trong dung dịch còn dư một kim loại chưa tan hết; đổ tiếp từ từ dung dịch Y (H2SO4 5M) vào, chất khí trên lại thoát ra cho đến khi kim loại vừa tan hết thì cần vừa hết 44ml, thu được dung dịch Y. Lấy 1/2 dung dịch Y, cho dung dịch NaOH dư vào, lọc lấy kết tủa, nung trong không khí đến khối lượng không đổi được chất rắn Z nặng 15,6 gam. Số mol Fe có trong hỗn hợp X là
nMg = a; nFe = b; nCu = c
⇒ mX = 24a + 56b + 64c = 23,52 (1)
nH+ = 0,2. 3,4 + 0,044. 5. 2 = 1,12
Do lần đầu, 1 kim loại dư nên Cu sẽ dư, dung dịch Y có: Mg2+, Cu2+, Fe2+
Ở lần hai, khi thêm H2SO4, do Cu có tính khử mạnh hơn Fe2+ nên khi Cu tan hết thì Fe2+ vẫn không phản ứng nên dung dịch Y cuối cùng sẽ có: Mg2+, Cu2+, Fe2+
nH+ = 8/3 nMg2+ + 8/3 nFe2+ + 8/3 nCu2+ ⇒ 8/3 a + 8/3 b + 8/3 c = 1,12 (2)
mOxit = mMgO + mFe2O3 + mCuO ⇒ 40a + 80b + 80c = 15,6. 2 = 31,2 (3)
Từ (1), (2), (3) ⇒ a = 0,06; b = 0,12 ; c = 0,24 ⇒ nFe = 0,12 mol.
→ Đáp án B
Câu 20:
Dung dịch X có 0,1 mol Fe2(SO4)3, 0,1 mol FeSO4 và 0,1 mol CuSO4. Cho khí H2S lội qua dung dịch X đến dư thì thu được m gam kết tủa. Giá trị của m là
nCuS = 0,1 mol;
Theo bảo toàn electron: 2 x nS = 1 x nFe3+ → nS = 0,1 x 2 : 2 = 0,1 mol.
→ m↓ = mS + mCuS = 0,1 x 32 + 0,1 x 96 = 12,8 gam
→ Đáp án C
Câu 21:
Nhiệt phân hoàn toàn hỗn hợp gồm x mol AgNO3 và y mol Cu(NO3)2 được hỗn hợp khí có M = 42,5 đvC. Tỉ số x/y là:
Tổng số NO2 và O2 thu được
nNO2 = x + 2y
nO2 = 0,5x + 0,5y
→ Đáp án A
Câu 22:
Hòa tan 1 gam một mẫu quặng chứa Au vào hỗn hợp cường thủy có dư, sau khi vàng hòa tan hoàn toàn thấy tiêu tốn 0,002 mol HNO3. Khối lượng Zn tối thiểu cần dùng để thu hồi lượng Au từ dung dịch thu được là:
• Bản chất của phản ứng là quá trình oxi hóa, khử:
N+5 + 3e → N+2
Zn → Zn+2 + 2e
Au + nước cường toan thì N trong HNO3 chuyển hết về NO → nNO = 0,002 mol.
Theo bảo toàn e: 3 x nNO = 2 x nZn → nZn = 0,002 x 3/2 = 0,003 mol
→ mZn = 0,003 x 65 = 0,195 gam
→ Đáp án A
Câu 23:
X là hỗn hợp gồm Fe và hai oxit của sắt. Hòa tan hết 15,12 gam X trong dung dịch HCl dư, sau phản ứng thu được 16,51 gam muối Fe (II) và m gam muối Fe (III). Mặt khác, khi cho 15,12 gam X phản ứng hoàn toàn với dung dịch acid nitric loãng dư thì giải phóng 1,568 lít NO (sản phẩm khử duy nhất, đo ở đktc). Thành phần % về khối lượng của Fe trong X là ?
Có hỗn hợp X gồm Fe và O với số mol lần lượt là a, b(mol)
⇒ mX = 56a + 16b = 15,12
BT e: 3nFe = 2nO + 3nNO ⇒ 3a = 2b + 3. 0,07
⇒ a = b = 0,21
nFeCl2 = 16,51/127 = 0,13 ⇒ nFeCl3 = 0,21 - 0,13 = 0,08 mol
nH+ = nCl- = 0,13. 2 + 0,08. 3 = 0,5 mol
nH+ = 2nO + 2nH2 ⇒ nH2 = (0,5 – 0,21. 2)/2 = 0,04 mol
nFe = nH2 = 0,04 mol
%Fe = (0,04. 56)/15,12 = 14,81%
→ Đáp án C
Câu 24:
Hòa tan hoàn toàn hỗn hợp X (gồm x mol Fe, y mol Cu, z mol Fe2O3 và t mol Fe3O4) trong dung dịch HCl không thấy có khí bay ra khỏi bình, dung dịch thu được chỉ chứa 2 muối. Mối quan hệ giữa số mol các chất có trong hỗn hợp X là
Hỗn hợp X gồm:
(dung dịch chứa hai muối)
• Sau phản ứng không có khí thoát ra → Fe, Cu phản ứng hết với Fe3+
Theo bảo toàn electron ta có 2 x nFe + 2 x nCu = 1 x nFe3+ (Fe2O3) + 1 x nFe+3 (Fe3O4)
→ 2x + 2y = 2z + 2t → x + y = z + t → Đáp án đúng là đáp án A.
Chú ý: Có thể xác định số mol Fe3+ trong Fe3O4 bằng phương trình
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O.
→ Đáp án A
Câu 25:
Nung nóng 16,8 gam hỗn hợp Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là:
Theo ĐL bảo toàn khối lượng:
mO2 = 23,2 - 16,8 = 6,4 (g) → nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
O2- (0,4) + 2H+ (0,8) → H2O
VHCl = 0,8 : 2 = 0,4 (lít) = 400ml
→ Đáp án D
Câu 26:
Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là.
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64x = 12 ⇒ x = 0,1 mol
Mặt khác: dx/H2 = 19 ⇒ MX = 38
Đặt x, y là số mol của NO và NO2 thì 30x + 46y = 38(x + y) ⇒ x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 ⇒ 4x = 0,5 . Vậy x = 0,125 mol
V = 0,125. 2. 22,4 = 5,6 lít
→ Đáp án B
Câu 27:
Khi hoà tan hoàn toàn 0,05 mol Au bằng nước cường toan thì số mol HCl phản ứng và số mol NO sản phẩm khử duy nhất lần lượt là:
Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O
⇒ nNO = 0,05 mol; nHCl = 3. 0,05 = 0,15 mol
→ Đáp án C
Câu 28:
Hòa tan hết a gam hỗn hợp X gồm Fe và một oxit sắt trong b gam dung dịch H2SO4 9,8% (lượng vừa đủ), sau phản ứng thu được dung dịch chứa 51,76 gam hỗn hợp hai muối khan. Mặt khác nếu hòa tan hết a gam X bằng dung dịch H2SO4 đặc nóng thì thu được duy nhất 58 gam muối Fe (III). Giá trị của b là:
nFe2(SO4)3 = 58/400 = 0,145 mol
nFeSO4 = a; nFe2(SO4)3 = b
⇒ 152a + 400b = 51,76
BT Fe: a + 2b = 0,145. 2 = 0,29 ⇒ a = 0,13 mol; b = 0,08 mol
BT S: nH2SO4 = nFeSO4 + 3nFe2(SO4)3 = 0,13 + 3. 0,08 = 0,37
⇒ b = (0,37.98)/0,098 = 370g
→ Đáp án A
Câu 29:
Cho 5,36 gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn được dung dịch Y. Cô cạn Y được 3,81 gam FeCl2 và m gam FeCl3. Giá trị của m là
5,36 gam FeO, Fe2O3, Fe3O4 + HCldư → ddY.
Cô cạn Y → 0,03 mol FeCl2 và m gam FeCl3.
Coi hỗn hợp X gồm FeO và Fe2O3
nFeO = nFeCl2 = 0,03 → mFe3O4 = 5,36 - 0,03 x 72 = 3,2 gam → nFe2O3 = 3,2 : 160 = 0,02 mol
→ nFeCl3 = 0,02 x 2 = 0,04 mol → mFeCl3 = 0,04 x 162,5 = 6,5 gam
→ Đáp án A
Câu 30:
Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Quy hỗn hợp X về 2 chất Fe và Fe2O3:
Hòa tan hỗn hợp X vào dung dịch HNO3 dư ta có:
Fe (0,1/3) + 6HNO3 → Fe(NO3)2 (0,1) + 3NO2 + 3H2O
⇒ Số mol nguyên tử Fe trong oxit Fe2O3 là
Vậy mX = mFe + mFe2O3
→ Đáp án A
Câu 31:
Dẫn luồng khí CO dư qua ống đựng 0,03 mol oxit sắt, khí sau phản ứng cho vào dung dịch Ca(OH)2 dư thu được 12 g kết tủa. Vậy công thức của oxit sắt là:
Ta có: nCaCO3 = 12/100 = 0,12 mol
Xét sơ đồ sau:
Ta có: 0,03y = 0,12 → y = 4
→ Đáp án A
Câu 32:
Y là một hỗn hợp gồm sắt và hai oxit của nó. Chia Y làm hai phần bằng nhau :
Phần 1: Đem hòa tan hết trong dung dịch HCl dư thu được dung dịch Z chứa a gam FeCl2 và 13 gam FeCl3.
Phần 2: Cho tác dụng hết với 875 ml dung dịch HNO3 0,8M (vừa đủ) thu được 1,568 lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của a là
Đáp án B
Bảo toàn N:
nNO3- = nHNO3 – nNO = 0,875. 0,8 – 0,07 = 0,63 ⇒ n Fe(NO3)3 =0,21 mol
nFeCl3 = 0,08 mol ⇒ nFeCl2 = 0,21 – 0,08 =0,13 ⇒ mFeCl2 = 16,51g
Câu 33:
Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4, khuấy nhẹ cho đến khi phản ứng thực hiện xong. Khối lượng kim loại có trong bình phản ứng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
Khối lượng kim loại tăng: 1,88 – (1,12 + 0,24) = 0,52 (gam)
Trước hết, Mg tác dụng với CuSO4
Mg + CuSO4 → MgSO4 + Cu (1)
nMg = 0,1 mol ⇒ nCuSO4 = 0,1 mol
Từ (1) ⇒ 0,1 mol Mg tác dụng với 0,1 mol CuSO4 sinh ra 0,01 mol Cu đã làm cho khối lượng kim loại tăng: 0,01.(64 – 24) = 0,4 (gam)
⇒ Phản ứng giữa Fe và CuSO4 làm cho khối lượng kim loại tăng: 0,52 – 0,4 = 0,12 g
Fe + CuSO4 → FeSO4 + Cu (2)
⇒ nCuSO4 (2) = (1 x 0,12)/8 = 0,015 (mol)
Vậy CM(CuSO4) = (0,01 + 0,015)/0,25 = 0,1 (mol/l)
→ Đáp án A
Câu 34:
Cho 23,8 gam kim loại M tan hết trong dung dịch H2SO4 loãng tạo ra ion M2+. Dung dịch tạo thành có thể tác dụng vừa đủ với 200 ml dung dịch Fe2(SO4)3 1M để tạo ra ion M4+ và Fe2+. M là
Nhận thấy M có thể tan trong dung dịch H2SO4 loãng → Loại Au, Pb
Ion M2+ + Fe3+ → M4+ + Fe2+ → chỉ có đáp án A thỏa mãn .
Sn + H2SO4 → SnSO4 + H2
SnSO4 + Fe2(SO4)3 → Sn(SO4)2 + 2FeSO4.
→ Đáp án A
Câu 35:
Nhúng một miếng đồng vào dung dịch chứa 100 ml AgNO3 0,3M. Sau một thời gian lấy miếng đồng ra thấy khối lượng tăng lên 1,52 gam. Vậy nồng độ của AgNO3 sau phản ứng là:
số mol AgNO3 = 0,03 (mol)
Phương trình phản ứng:
Ta có: 108.2a - 64a = 152a = 1,52 → a = 0,01 (mol)
Số mol AgNO3 còn lại = 0,03 - 2.a = 0,03 - 2.0,01 = 0,01 mol
Nồng độ AgNO3 = 0,01/0,1 = 0,1M
→ Đáp án A
Câu 36:
Đốt cháy hoàn toàn hỗn hợp gồm FeS2 và Ag2S với số mol bằng nhau thu được 3,696 lít SO2 (đktc) và chất rắn B. Cho B tác dụng với dung dịch H2SO4 loãng dư, sau phản ứng hoàn toàn thấy còn lại m gam chất rắn không tan. Giá trị của m là:
nFeS2 = nAg2S = 1/3 nSO2 = 0,055 mol
Chất rắn B gồm có Fe2O3 và Ag, cho qua H2SO4 thì chỉ còn lại Ag
⇒ m = 0,055. 2. 108 = 11,88
→ Đáp án B
Câu 37:
Hoà tan một đinh thép có khối lượng 1,14 gam bằng dd H2SO4 loãng dư, phản ứng xong loại bỏ kết tủa, được dd X. Dd X làm mất màu 40 ml dd KMnO4 0,1M. Hàm lượng sắt nguyên chất có trong đinh thép là (Cho rằng trong đinh thép, chỉ có Fe tác dụng với H2SO4 loãng)
1,14 gam thép + H2SO4 dư → ddX gồm FeSO4, H2SO4 dư.
FeSO4 + 0,004 mol KMnO4
Theo bảo toàn electron 1 x nFeSO4 = 5 x nKMnO4 → nFeSO4 = 5 x 0,004 = 0,02 mol.
→ nFe = 0,02 mol → %Fe = 0,02 x 56 : 1,14 ≈ 98,2%
→ Đáp án B
Câu 38:
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phầm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là:
Ta có: nSO2 = 0,145 mol
Quy đổi 20,88 g oxit sắt FexOy thành 20,88 g Fe và O
Gọi nFe = x mol; nO = y mol
Quá trình nhường electron:
- Quá trình nhận electron:
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,29 → 3x - 2y = 0,29 (1)
Mặt khác: 56x + 16y = 20,88 (2)
Từ (1) và (2) → x = 0,29 và y = 0,29
Muối sinh ra là muối Fe2(SO4)3. Áp dụng ĐL bảo toàn nguyên tố ta có:
⇒ nFe2(SO4)3 = 1/2 nFe = 0,145 mol → mFe2(SO4)3= 0,145. 400 = 58 (g)
→ Đáp án D
Câu 39:
Hòa tan hoàn toàn 11,15 gam hỗn hợp X gồm crom và thiếc vào dung dịch HCl dư thu được 3,36 lít H2 (đktc). Số mol O2 cần dùng để đốt cháy hoàn toàn 11,15 gam X là:
Chú ý Cr, Sn tác dụng với HCl thì hình thành Cr2+, Sn2+ và khi tác dụng với Cr3+ và Sn4+
Gọi số mol Cr, Sn lần lượt là x, y
Ta có hệ
Bảo toàn electron → nO2= 0,125 mol.
→ Đáp án C
Câu 40:
Hòa tan m gam hỗn hợp X gồm FeO, Fe(OH)2, FeCO3, Fe2O3, Fe3O4 có cùng số mol tác dụng với dung dịch H2SO4 loãng dư thu được 1,568 lít khí CO2 (đktc) và dung dịch Y. Dung dịch Y có thể làm mất màu bao nhiêu ml dung dịch KMnO4 1M ?
m gam hỗn hợp X gồm
ddX + V ml KMnO4.
- nFeCO3 = a = 0,07 mol.
∑nFe2+ = 4a = 4 x 0,07 = 0,28 mol.
- ddY + KMnO4
Theo bảo toàn electron: 1 x nFe2+ = 5 x nKMnO4 → nKMnO4 = 0,28 : 5 = 0,056 mol
→ VKMnO4 = 0,056 : 1 = 0,056 lít = 56ml
→ Đáp án D
