Đề kiểm tra giữa học kì 2 Hóa 12 có đáp án (Mới nhất) (Đề 1)
-
2393 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Đáp án C
Kim loại có những tính chất vật lí chung:
+ Tính dẻo;
+ Tính dẫn điện;
+ Tính dẫn nhiệt;
+ Có ánh kim.Câu 2:
Đáp án B
Tính oxi hóa của ion kim loại tăng dần theo thứ tự:
Al3+ < Cu2+ < Fe3+ < Ag+.
Vậy Al3+ có tính oxi hóa yếu nhấtCâu 3:
Đáp án C
CaO + H2O → Ca(OH)2.Câu 4:
Đáp án C
Trong 4 đáp án chỉ có nhôm là kim loại nhẹCâu 5:
Đáp án D
Trong dãy trên, Ag là kim loại dẫn điện tốt nhất, sau đó đến Cu, Al, cuối cùng là FeCâu 6:
1) Làm giảm nhiệt độ nóng chảy của Al2O3.
2) Tiết kiệm được năng lượng, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3.
3) Tạo chất lỏng có tỉ khối nhỏ hơn nhôm, nổi lên bề mặt nhôm ngăn cản nhôm nóng chảy bị oxi hoáĐáp án D
Criolit được sử dụng với các mục đích:
1) Làm giảm nhiệt độ nóng chảy của Al2O3.
2) Tiết kiệm được năng lượng, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3.
3) Tạo chất lỏng có tỉ khối nhỏ hơn nhôm, nổi lên bề mặt nhôm ngăn cản nhôm nóng chảy bị oxi hoáCâu 7:
Đáp án B
Phát biểu B không đúng vì CO không khử được Al2O3Câu 8:
Đáp án A
Đặt 2 kim loại Na và M tương đương với 1 kim loại là .
Theo bài ra ta có các phương trình hóa học:
Có MNa = 23 > 15 nên MM < 15. Vậy M là Li.
Câu 9:
Đáp án C
Ta có phương trình hóa học:
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
Số phân tử HNO3 tạo môi trường trong muối là 8.3 = 24.
Số phân tử HNO3 đóng vai trò là chất oxi hóa là 30 – 24 = 6.
⇒ Tỉ lệ: 24 : 6 = 4 : 1Câu 10:
Đáp án B
Ta có: nHCl = 0,006 mol; nNaOH = 0,005 mol.
Phương trình phản ứng :
NaOH + HCl → NaCl + H2O
0,005 0,006 mol
Thực hiện phản ứng trung hòa HCl dư 0,001 mol
Vdd sau trộn = 0,05 + 0,05 = 0,1 (lít)
=> CM (HCl) = 0,01M ⇒ pH = -log(0,01) = 2Câu 11:
Đáp án A
Xét phản ứng Y + NaOH, do thu được kết tủa lớn nhất nên chỉ xảy ra phản ứng trao đổi, thay thế NO3- bằng OH-.
Khối lượng kim loại trong kết tủa: mKL = 6,67 – mOH- = 3,95 gam.
Bảo toàn khối lượng kim loại:
m + 0,03.65 + 0,05.64 = 5,25 + 3,95
⇒ m = 4,05 gam.Câu 12:
Đáp án B
Các chất tác dụng với NaOH ở điều kiện thường: NaHCO3; Al(OH)3; HF; Cl2; NH4Cl.
Phương trình hóa học minh họa:
NaHCO3 + NaOH → Na2CO3 + H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
HF + NaOH → NaF + H2O
Cl2 + 2NaOH → NaCl + NaClO + H2O
NH4Cl + NaOH → NH3↑ + NaCl + H2O
Câu 13:
Đáp án A
Những kim loại có độ hoạt động trung bình như Zn, Fe, Sn, Pb ... thường được điều chế bằng phương pháp nhiệt luyện, nghĩa là khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2 hoặc các kim loại hoạt độngCâu 14:
Đáp án A
Kim loại có nhiệt độ nóng chảy thấp nhất trong dãy là Cs (nóng chảy ở 29oC).
Câu 16:
Đáp án C
Be không tác dụng với nướcCâu 17:
Đáp án C
Đặt 2 muối tương đương với một muối là
(ĐK: MM + 1 < < 2MM)
Bảo toàn nguyên tố C có:
= nkhí = 0,022 mol ⇒ = 172,72.
⇒ =172,72 – 60 = 112,72.
Có MM + 1 < 112,72 < 2MM
⇒ 56,1 < MM < 111,72 ⇒ M là RbCâu 18:
Đáp án D
Ca + 2HCl → CaCl2 + H2
x → 2x mol
MgO + 2HCl → MgCl2 + H2O
y → 2y mol
Na2O + 2HCl → 2NaCl + H2O
z → 2z 2z mol
Có mx = 8,52 ⇒ 40x + 40y + 62z = 8,52 (1)
Lại có naxit = 0,72 ⇒ 2x + 2y + 2z = 0,36 (2)
Từ (1) và (2) giải hệ được x + y = 0,12; z = 0,06
⇒ mNaCl = 2z.58,5 = 2. 0,06.58,5 = 7,02 gam.
Câu 19:
Đáp án B
nOH- = 0,2.1 + 2.0,2.0,5 = 0,4 (mol)
Đặt ⇒ OH- dư.
Vậy khối lượng kết tủa: m↓ = 0,1.197 = 19,7 gam
Câu 20:
Dung dịch X gồm Na2CO3; K2CO3; NaHCO3. Chia X thành 2 phần bằng nhau:
- Phần 1 tác dụng với nước vôi trong dư thu được 20 gam kết tủa.
- Phần 2 tác dụng với dung dịch HCl dư thu được V lít khí CO2 ở đktc. Giá trị của V làĐáp án B
Bảo toàn nguyên tố cacbon có:
Vậy V = 0,2.22,4 = 4,48 lít.
Câu 21:
Đáp án C
Sơ đồ phản ứng:
Nhận thấy trong toàn bộ quá trình các chất trong hỗn hợp A không thay đổi số oxi hóa, Al thay đổi số oxi hóa từ 0 lên +3.
Áp dụng định luật bảo toàn mol electron, ta có:
Nên (gam)Câu 22:
Đáp án B
Trong 4 cấu hình electron chỉ có trường hợp 1s22s22p63s23p1 thỏa mãn điều kiện X thuộc chu kì nhỏ và dễ mất 3 electronCâu 23:
Đáp án A
Để lượng kết tủa thu được là lớn nhất thì SO42- phản ứng hết, Ba(OH)2 không dư (nếu dư lại hòa tan Al(OH)3↓)
Vậy khối lượng kết tủa lớn nhất thu được là:
m = = (0,024 – 0,02).78 + 0,046.233 = 11,03 (gam).Câu 24:
(a) Kim loại mạnh luôn đẩy kim loại yếu hơn ra khỏi muối của nó.
(b) Những kim loại như Na, K, Ba, Ca chỉ có thể điều chế bằng cách điện phân nóng chảy.
(c) Tráng Sn lên sắt để sắt không bị ăn mòn là phương pháp bảo vệ kim loại bằng phương pháp điện hóa.
(d) Các kim loại kiềm có cùng kiểu cấu trúc mạng tinh thể.
(e) Hầu hết các hợp chất của kim loại kiềm đều tan tốt trong nước.
(f) Các muối của kim loại kiềm đều có môi trường trung tính.
(g) Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
Có bao nhiêu nhận xét đúng?Đáp án B
Các nhận xét đúng là: b, d, e, g.
Nhận xét a sai vì các kim loại Na, K… tác dụng với H2O có trong dung dịch trước.
Nhận xét c sai vì tráng Sn lên sắt để sắt không bị ăn mòn là phương pháp bảo vệ kim loại bằng phương pháp che phủ bề mặt.
Nhận xét f sai vì môi trường của muối còn phụ thuộc vào gốc axitCâu 25:
Đáp án B
Gọi số mol K2CO3 và KHCO3 phản ứng lần lượt là x và y mol.
Ta có: (1)
![]()
⇒ nHCl = 2x + y = 0,3 (2)
Giải hệ phương trình được: x = 0,075 và y = 0,15.
Bảo toàn C có số mol CO2 = x + y = 0,225 mol
Vậy thể tích CO2 là: 0,225.22,4 = 5,04 lít.Câu 26:
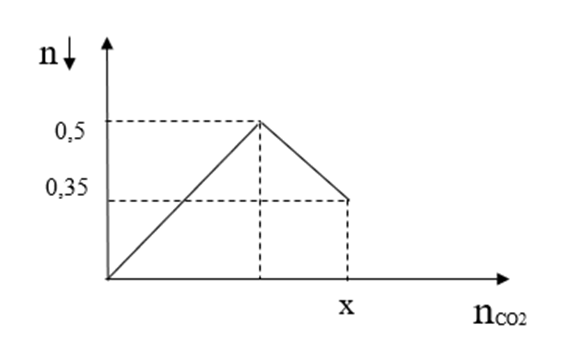
Giá trị của x là
Đáp án B
Theo hình vẽ:
Khi phản ứng kết thúc:
Câu 27:
Đáp án D
Cực dương Cl- bị oxi hóa:
2Cl- → Cl2 + 2e
Cực âm Na+ không bị khử, thay vào đó H2O bị khử:
2H2O + 2e → H2 + 2OH-Câu 28:
Đáp án D
Áp dụng công thức Farađay:
Vậy kim loại là đồng (Cu).
Câu 29:
Đáp án D
Đặt hỗn hợp kim loại tương ứng với 1 kim loại là R có hóa trị n.
4R + nO2 2R2On (1)
Do oxi dư nên sản phẩm sinh ra chỉ có oxit:
R2On + 2nHCl → 2RCln + nH2O (2)
Áp dụng định luật bảo toàn khối lượng có:
Bảo toàn O có:
Từ (2) có nHCl = 2.nO(oxit) = 0,16 (mol)
⇒ V = (lít) = 320 (ml).Câu 30:
Đáp án D
Ta có:
ne =
Cực âm:
Cu2+ + 2e → Cu
0,12 ← 0,24 mol
Cực dương:
Dung dịch sau điện phân gồm: Cu2+ dư 0,08 mol; : 0,2 mol; H+: 0,12 mol; Na+: 0,12 mol
Nhúng thanh Mg vào dung dịch sau điện phân:
Khối lượng thanh Mg thay đổi sau phản ứng là:
∆m = mCu – mMg pư = 0,08.64 – 0,14.24 = 1,76 (gam).
Vậy sau phản ứng thanh Mg tăng 1,76 gam.