Trắc nghiệm chuyên đề Hóa 12 Chủ đề 6: Phương pháp quy đổi trong hóa học vô cơ (Có đáp án)
Bài tập rèn luyện
-
330 lượt thi
-
8 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y. Cô cạn dung dịch Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
Xem Fe3O4 là FeO.Fe2O3
Ta có:
mFeCl3 = 0,06.162,5 = 9,75 (g)
Đáp án A
Câu 2:
Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
Cách 1: Quy hỗn hợp X về 2 chất Fe và Fe2O3:
Hòa tan hỗn hợp X vào dung dịch HNO3 dư ta có:
⇒ Số mol nguyên tử Fe trong oxit Fe2O3 là
Vậy mX = mFe + mFe2O3
![]()
Cách 2: Quy hỗn hợp X về hai chất FeO và Fe2O3:
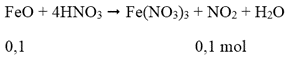
Ta có: 0,15 mol
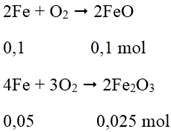
mhh X = 0,1.72 + 0,025.160 = 11,2 gam
Chú ý: Vẫn có thể quy hỗn hợp X về hai chất (FeO và Fe3O4) hoặc (Fe và FeO), hoặc (Fe và Fe3O4) nhưng việc giải trở nên phức tạp hơn (cụ thể là ta phải đặt ẩn số mol mỗi chất, lập hệ phương trình, giải hệ phương trình hai ẩn số).
Cách 3: Quy hỗn hợp X về một chất là FexOy
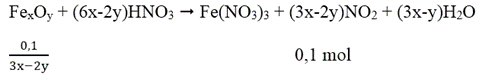
![]()
Vậy công thức quy đổi là Fe6O7 (M = 448) và
nFe6O7 = 0,1/(3.6 - 2.7 ) = 0,025 mol
mX = 0,025.448 = 11,2 gam
Nhận xét: quy đổi hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4 về hỗn hợp hai chất là FeO và Fe2O3 là đơn giản nhất.
Đáp Án A
Câu 3:
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 (sản phầm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là:
Đáp án: D
Ta có: nSO2 = 0,145 mol
Quy đổi 20,88 g oxit sắt FexOy thành 20,88 g Fe và O
Gọi nFe = x mol; nO = y mol
Quá trình nhường electron:
- Quá trình nhận electron:
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,29 ⇒ 3x - 2y = 0,29 (1)
Mặt khác: 56x + 16y = 20,88 (2)
Từ (1) và (2) ⇒ x = 0,29 và y = 0,29
Muối sinh ra là muối Fe2(SO4)3. Áp dụng ĐL bảo toàn nguyên tố ta có:
![]()
Câu 4:
Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất) (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là:
Đáp án: A
Quy đổi hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 thành Fe và Fe2O3.
Vậy muối = (0,1 + 0,06).242 = 38,72 (g)
* Cách 2:
Xem hỗn hợp Fe, FeO, Fe2O3 và Fe3O4 chỉ gồm 2 nguyên tố Fe và O
Ta có sơ đồ: Fe: x mol; Fe(NO3)3: x mol
O : y mol
Ta có 56x + 16y = 11,36 (1)
- Quá trình nhường electron:
- Quá trình nhận electron:
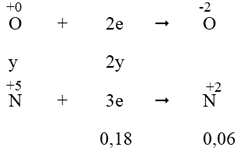
Áp dụng định luật bảo toàn electron, ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) ⇒ x = 0,16 mol và y = 0,15 mol
mFe(NO3)3 = 0,16.242 = 38,72 (g)
Câu 5:
Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Tính m ?
Đáp án: B
Số mol NO = 0,06 mol.
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Gọi số mol Fe và O tương ứng trong X là x và y ta có:
56x + 16y = 11,36 (1).
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
N+5 + 3e → N+2
Áp dụng định luật bảo toàn electron ta có: 3x = 2y + 0,18 (2)
Từ (1) và (2) ⇒ x = 0,16 và y = 0,15
⇒ m = 38,72 gam.
Câu 6:
Đáp án:C
Vì số mol của FeO bằng số mol của Fe2O3 nên ta coi hỗn hợp là Fe3O4
Ta có
Trong 100 ml X sẽ có 0,01 mol FeSO4 nên:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
→ nKMnO4 = 0,02 mol → VKMnO4 = 0,02/0,1 = 0,2 lit
Câu 7:
Để khử hoàn toàn 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3, cần 0,05 mol H2. Mặt khác hoà tan hoàn toàn 3,04 gam hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được thể tích V ml SO2 (đktc). Giá trị V(ml) là:
Đáp án: B
Quy đổi hỗn hợp X về hỗn hợp hai chất FeO và Fe2O3 với số mol là x, y
Ta có:
Có: x + 3y = 0,05 và 72x + 160y = 3,04
⇒ x = 0,02mol; y = 0,01mol
Vậy VSO2 = 0,01 . 22,4 = 0,224 lít hay 224ml
Câu 8:
Nung nóng 12,6 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4 . Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 4,2 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
Đáp án: A
Ta có, nFe = 0,225 mol và nSO2 = 0,1875 mol
Quy hỗn hỗn hợp X về 2 nguyên tố Fe và O
Quá trình nhường: Fe0 → Fe+3 + 3e
Quá trình nhận e: O0 + 2e → O-2
S+6 + 2e → S+4
Áp dụng định luật bảo toàn electron ta có:
0,675 = 2x + 0,375 → x = 0,15
Mặt khác ta có: nên: m = 12,6 + 0,15.16 = 15 (gam).
