Trắc nghiệm chuyên đề Hóa 12 Chủ đề 10: Ôn tập và kiểm tra chuyên đề kim loại, kim loại kiềm thổ, nhôm có đáp án
Trắc nghiệm chuyên đề Hóa 12 Chủ đề 10: Ôn tập và kiểm tra chuyên đề kim loại, kim loại kiềm thổ, nhôm có đáp án
-
1116 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho 2g kim loại nhóm IIA tác dụng hết với dung dịch HCl tạo ra 5,55g muối clorua. Kim loại đó là kim loại nào sau đây?
Gọi M là kim loại nhóm II, số mol là x
M (x) + 2HCl → MCl2 x(mol) + H2
Theo đề bài ra ta có hệ phương trình:
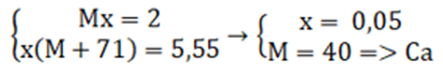
→ Đáp án C
Câu 2:
Cho 1,67 gam hỗn hợp gồm hai kim loại ở hai chu kỳ liên tiếp thuộc nhóm IIA tác dụng hết với dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (đktc). Tìm tên hai kim loại đem dùng.
Gọi R là kim loại hai chu kì liên tiếp của nhóm IIA.
Ta có: nH2 = 0,672/22,4 = 0,03(mol)
Phương trình hóa học:
R (0,03) + 2HCl → RCl2 + H2 (0,03) (1)
⇒ MR = 1,67/0,03 = 55,667
⇒ 2 kim loại cần tìm là: Ca và Sr.
→ Đáp án B
Câu 3:
Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
→ Đáp án B
Câu 4:
Nhận biết Al, Mg, Al2O3 dùng:
Lần lượt cho NaOH vào các mẫu thử. Chất rắn tan có khí thoát ra là Al, tan không có khí là Al2O3, không tan là MgO.
Phương trình hóa học:
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Al2O3 + 2NaOH → NaAlO2 + H2O
→ Đáp án D
Câu 5:
Cho 10g một kim loại kiềm thổ tác dụng với H2O, thu được 6,11 lít khí H2 (ở 25oC và 1 atm). Hãy xác định tên của kim loại kiềm thổ đã dùng.
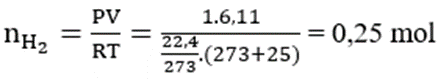
Gọi A là kí hiệu, nguyên tử khối của kim loại.
A (10/A) + 2H2O → A(OH)2 + H2 (0,25)
⇒ 10/A= 0,24 → A = 40 (Ca)
→ Đáp án B
Câu 6:
Hỗn hợp X gồm M2CO3, MHCO3, MCl với M là kim loại kiềm. Nung nóng 20,29 gam hỗn hợp X, sau khi phản ứng xảy ra hoàn toàn thấy còn lại 18,74 gam chất rắn. Cũng đem 20,29 gam hỗn hợp X tác dụng hết với 500ml dung dịch HCl 1M thì thoát ra 3,36 lít khí (đktc) và thu được dung dịch Y.Cho Y tác dụng với dung dịch AgNO3 dư thì thu được 74,62 gam kết tủa. Kim loại M là
+) Nung X:
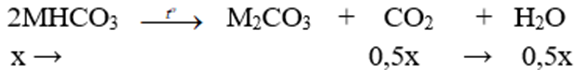
⇒ Δm giảm = mCO2 + mH2O ⇒ 31x = 20,29 – 18,74 ⇒ x = 0,05 mol
+) X + HCl:
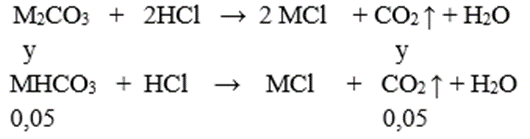
⇒ nCO2 = y + 0,05 = 0,15 ⇒ y = 0, 1 mol
Dung dịch Y chứa MCl và HCl dư. Gọi z là số mol MCl có trong X ta có:
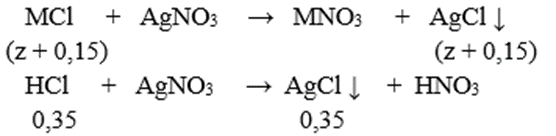
⇒ nAgCl = 0,5 + z = 74,62/143,5 = 0,52 ⇒ z = 0,02
⇒(2M + 60).0,1 + (M + 61). 0,05 + (M + 35,5).0,02 = 20,29 ⇒ M = 39(K)
→ Đáp án C
Câu 7:
Hòa tan hòa toàn 6,645g hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì liên tiếp nhau vào nước được dd X. Cho toàn bộ dd X tác dụng hoàn toàn với dd AgNO3 (dư), thu được 18,655g kết tủa. Hai kim loại kiềm trên là
MCl (0,13) + AgNO3 → AgCl (0,13) + MNO3
nAgCl = 18,655/143,5 = 0,13
⇒ M = (6,645/0,13) - 35,5 = 15,61
⇒ M1 = 9 (Li) < 15,61 < M2 = 23(Na)
→ Đáp án C
Câu 8:
Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
Dùng quì tím: chỉ nhận biết được dung dịch KOH.
- Dùng Zn, Al: không nhận biết được.
- Dùng BaCO3:
+ Cho vào dung dịch KOH không có hiện tượng
+ Cho vào dung dịch HCl có khí bay lên
+ Cho vào dung dịch H2SO4: có khí bay lên và kết tủa trắng
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
→ Đáp án D
Câu 9:
Cho 7,1 gam hỗn hợp gồm kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với lượng dư dd HCl loãng, thu được 5,6l khí (đktc). Kim loại X, Y là:
A (x) + HCl → ACl + 1/2 H2 (0,5 x)
B (y) + 2HCl → BCl2 + H2 (y)↑
⇒ nH2 = 0,5x + y = 0,25 ⇒ 0,25 < x + y < 0,5
⇒ 7,1/0,5 < M < 7,1/0,25 ⇒ 14,2 < M < 28,4
Chỉ có cặp nghiệm A = 23 (Na ), B = 24 (Mg) thỏa mãn
→ Đáp án A
Câu 10:
Hòa tan hết 10,1 gam hỗn hợp hai kim loại kiềm thuộc 2 chu kì liên tiếp vào nước thu được 3 lít dung dịch có pH = 13. Hai kim loại kiềm đó là:
pH = 13 ⇒ [OH-] = 0,1M ⇒ nOH- = 0,3 mol
M (0,3 ) + H2O → M+ + OH- (0,3) + 1/2 H2
⇒ 23(Na) < M = 10,1/0,3 = 33,67 < 39 (K)
→ Đáp án A
Câu 11:
Cho các chất rắn đựng trong các lọ mất nhãn BaO, MgO, Al2O3. Chỉ dùng một hóa chất nào sau đây có thể nhận biết được 3 chất trên?
- Hòa tan lần lượt các mẫu vào nước, mẫu chất rắn nào tan là BaO
PTHH: BaO + H2O → Ba(OH)2
- Lấy Ba(OH)2 cho vào 2 chất rắn, chất nào tan ra là Al2O3 còn lại là MgO
PTHH: Ba(OH)2 + Al2O3 + H2O → Ba(AlO2)2 + 2H2O
→ Đáp án A
Câu 12:
Cho 19 gam hỗn hợp gồm kim loại M ( hóa trị không đổi ) và Zn (có tỉ lệ mol tương ứng là 1,25:1) và bình đựng 4,48 lít khí Cl2 (đktc), sau các phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Cho X tan hết trong dung dịch HCl (dư) thấy có 5,6 lít khí H2 thoát ra (đktc). Kim loại M là:
M (1,25x) → Mn+ + ne (1,25nx)
Zn (x) → Zn2+ + 2e (2x)
Cl2 (0,2) + 2e (0,4) → 2Cl-
2H+ + 2e (0,5) → H2 (0,25)
Bảo toàn e ⇒ 1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M + 65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)
→ Đáp án A
Câu 13:
Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M và 0,224l khí H2 (đktc). Kim loại M là:
M: x mol; M2On: y mol
M (x) + nH2O → M(OH)n (x) + n/2 H2 (xn/2)
⇒ nx/2 = 0,01 ⇒ nx = 0,02
M2On (y) + nH2O → 2M(OH)n (2y)
⇒ nM(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01, y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
→ Đáp án B
Câu 14:
Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2 , NaOH, Na2 CO3, KHSO4, Na2 SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 ↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
→ Đáp án D
Câu 15:
Có 4 chất rắn đựng trong 4 lọ riêng biệt không nhãn: Na2CO3, CaCO3, Na2SO4 và CaSO4.H2O. Chỉ dùng cặp hóa chất nào sau đây có thể nhận được cả 4 chất trên?
Hòa tan vào nước ta chia làm 2 nhóm. Sau đó dùng HCl để nhận biết chất phản ứng với HCl tạo khí là muối CO32-
Nhóm 1: Na2SO4 và Na2CO3
Nhóm 2: CaCO3 và CaSO4.H2O
PT: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Chú ý: Muối cacbonat giải phóng khí CO2 khi tác dụng với axit.
→ Đáp án B
Câu 16:
Nung 13,4 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2, thu được 6,8 gam chất rắn và khí X. Lượng khí X sinh ra cho hấp thụ vào 75ml dung dịch NaOH 1M. Khối lượng muối khan thu được sau phản ứng là:
Gọi công thức chung của hai muối cacbonat kim loại hóa trị II là RCO3
RCO3 -to→ RO + CO2
Áp dụng định luật bảo toàn khối lượng ta có:
mCO2 = mRCO3 - mRO = 13,4 - 6,8 = 6,6 (g)
nCO2 = 0,15 mol
Ta có: nNaOH = 0,075 mol
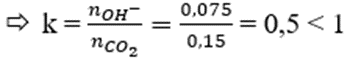
→ tạo ra muối NaHCO3 và CO2 dư.
CO2 + NaOH (0,075) → NaHCO3 (0,075)
→ mmuối = 0,075.84 = 6,3(g)
→ Đáp án D
Câu 17:
Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa. Tìm giá trị lớn nhất của V?
Số mol Al3+ = 0,34 mol.
Số mol Al(OH)3 = 0,3 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3. 0,3 = 0,9 mol.
→ V(dd NaOH) = 2,25 lít = Vmin
+ TH2: Al3+ hết → tạo
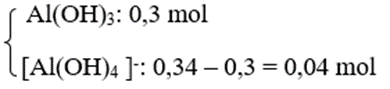
→ Số mol OH- = 3. 0,3 + 4. 0,04 = 1,06 mol
→ V(dd NaOH) = 2,65 lít = Vmax
→ Đáp án A
Câu 18:
Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là:
nFe = 3,36/56 = 0,06 mol
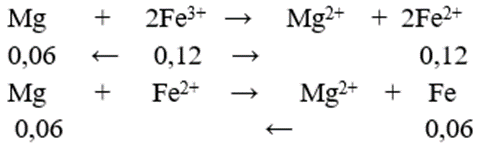
→ m = 0,12. 24 = 2,88 gam
→ Đáp án A
Câu 19:
. Sau khi thực hiện phản ứng nhiệt nhôm với Fe3O4 thu được chất rắn A và nhận thấy khối lượng nhiệt nhôm tăng 0,96(g). Cho A tác dụng với dung dịch NaOH dư thu được 0,672 lít khí (đktc), (giả sử các phản ứng đều xảy ra với hiệu suất 100%). Khối lượng của A là:
8Al + 3Fe3O4 -to→ 9Fe + 4Al2O3
Khối lượng nhôm tăng chính là khối lượng của nguyên tố oxi.
nO (trong Al2O3) = 0,96/16 =0,06 mol
nAl2O3 = 1/3. nO = 0,06/3 = 0,02 mol
Theo phản ứng: nFe = 9/4. nAl2O3 = (9/4). 0,02 = 0,045 mol
Hỗn hợp A sau phản ứng tác dụng với NaOH dư tạo ra khí H2. Chứng tỏ sau phản ứng nhiệt nhôm, nhôm còn dư:
Ta có: nH2 = 0,672/22,4 = 0,03 mol
Al (0,02) + NaOH + H2O → NaAlO2 + 3/2 H2 (0,03)
Vậy: mA = mAl dư + mAl2O3 = 0,02.27 + 0,045.56 + 0,02.102 = 5,1 (g)
→ Đáp án D
Câu 20:
Khối lượng riêng của canxi kim loại là 1,55g/cm3. Giả thiết cho rằng trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể , phần còn lại là khe rỗng. Bán kính nguyên tử canxi theo lý thuyết là :
d = mNT/VTT = 0,74. mNT/VTT
⇒ VTT = 4πr3/3 = 0,74. mNT/d = (0,74.40)/(6,02.1023.2,55)
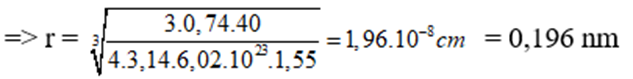
→ Đáp án B
Câu 21:
Hòa tan 7,8 gam một kim loại R vào nước thu được 100ml dung dịch D và 2,24 lít H2 (đktc). Vậy R và nồng độ mol của dung dịch D là:
Số mol H2 = 0,1 mol
Phương trình phản ứng: 2M (0,2) + 2H2O (0,2) → 2MOH + H2 (0,1)
Tính được M = m : n = 7,8 : 0,2 = 39. Vậy kim loại cần tìm là K.
CM = 0,2/0,1 = 2M
→ Đáp án B
Câu 22:
Cho m gam NaOH vào 2 lít dd NaHCO3 nồng độ a mol/l, thu được 2 lít dung dịch X. Lấy 1 lít dung dịch X tác dụng với dd BaCl2 (dư ) thu được 11,82g kết tủa . Mặt khác , cho 1 lít dd X vào dd CaCl2(dư) rồi đun nóng. Sau khi kết thúc các phản ứng thu được 7,0g kết tủa. Giá trị của a, m tương ứng là:
+) 1/2 X + BaCl2:
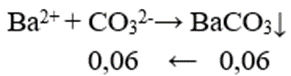
+) 1/2 X + CaCl2:
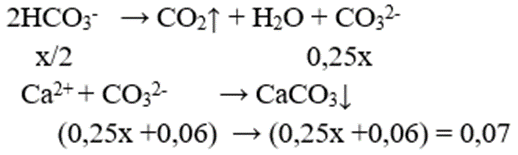
⇒ x = 0,04 mol
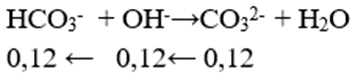
⇒ tổng nHCO3- = 0,12 + 0,04 = 0,06 mol
⇒ a = 0,08 mol/l
⇒ m = 40.0,12 = 4,8 g
→ Đáp án C
Câu 23:
Hấp thụ hoàn toàn 3,36 lít khí CO2 (ở đktc) vào m gam dung dịch hỗn hợp chứa 0,05 mol NaOH; 0,05mol KOH; 0,05 mol Ba(OH)2. Dung dịch sau phản ứng có khối lượng ?
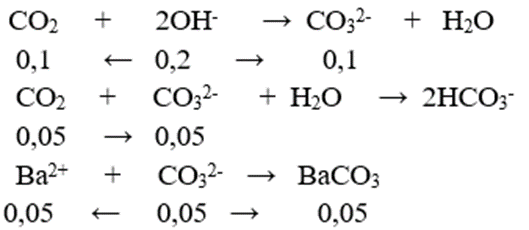
⇒ mdd = m + 0,15.44 – 197.0,05 = (m – 3,25) gam
→ Đáp án D
Câu 24:
. Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào 100 ml dung dịch gồm K2CO3 0,2M và KOH x mol/lít, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho toàn bộ Y tác dụng với dung dịch BaCl2 (dư) thu được 11,82 gam kết tủa. Giá trị của X là:
Ta có: nCO2 = 0,1 mol; nBaCO3 = 11,82/197 = 0,06 mol; nK2CO3 = 0,02 mol
Khi sục CO2 vào dung dịch hỗn hợp K2CO3 và KOH, giả sử chỉ xảy ra phản ứng:
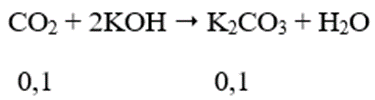
⇒ nK2CO3 (trong dd) = 0,1 + 0,02 = 0,12 mol
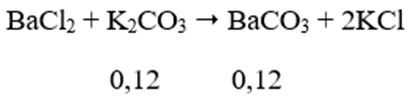
Ta thấy n↓ = 0,12 → n↓ đề cho = 0,06 mol
Vậy trong phản ứng CO2 với KOH ngoài muối K2CO3 còn có muối KHCO3
Áp dụng định luật bảo toàn nguyên tố C ta có:
nC(trong CO2) + nC(trong K2CO3) = nC(trong BaCO3) + nC(trong KHCO3)
⇒ 0,1 + 0,02 = 0,06 + x (x là số mol BaCO3)
⇒ x = 0,06

→ nKOH = 0,14 mol → [KOH] = 0,14/0,1 = 1,4M
→ Đáp án B
Câu 25:
Cho 0,96 gam bột Cu và dung dịch HNO3 đặc, nóng (dư) sau phản ứng hấp thụ hết khí thoát ra vào 0,4 lít dung dịch KOH 0,1M thu được 0,4 lít dung dịch X. Dung dịch X có giá trị pH là( bỏ qua sự điện li của H2O) và phản ứng của các muối)
nNO2 = 2nCu = 0,03 mol
2NO2 (0,03) + 2NaOH (0,03) → NaNO2 + NaNO3 + H2O
⇒ nNaOH còn = 0,04 - 0,03 = 0,01 mol
⇒ [OH-] = 0,01/0,04 = 0,025 M
⇒ pH = 14 + lg 0,025 = 12,4
→ Đáp án A
Câu 26:
Cho từ từ dung dịch chứa a mol HCl vào dung dịch chứa b mol Na2CO3 đồng thời khuấy đều, thu được V lít khí (ở đktc) và dung dịch X. Khi cho dư nước vôi trong vào dung dịch X thấy có xuất hiện kết tủa. Biểu thức liên hệ giữa V với a, b là:
Đáp án D
Câu 27:
Đốt cháy 16,1 gam Na trong bình chứa đầy khí O2, sau một thời gian thu được m gam hỗn hợp chất rắn Y gồm Na2O, Na2O2 và Na dư. Hòa tan hết toàn bộ lượng Y trên vào nước nóng, sinh ra 5,04 lít (đktc) hỗn hợp khí Z, có tỉ khối so với He là 3. Giá trị của m là
Z gồm H2, O2. mZ = 4.3.0,225 = 2,7 g
Gọi a, b lần lượt là số mol H2, O2
Ta có hệ :
a + b = 0,225 (1)
2a + 32b = 2,7 (2)
⇒ a = 0,15 , b = 0,075
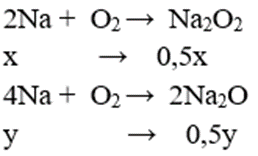
⇒ nNa còn = 0,7 - (x + y)
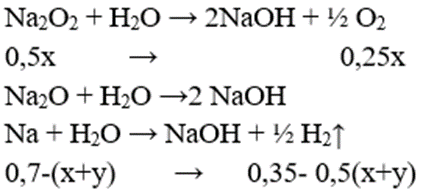
⇒ nO2 = 0,25x = 0,075 mol ⇒ x = 0,3 mol
⇒ nH2 = 0,35 - 0,5(x + y) = 0,15 ⇒ y = 0,1 mol
⇒ m = mNa2O2 + mNa2O + mNa dư = 78.0,15 + 62.0,05 + 23.0,3 = 21,7 g
→ Đáp án B
Câu 28:
Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1: 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
Ta có: nH2 = 0,04 mol
Gọi: nNa = x mol → nAl = 2x mol
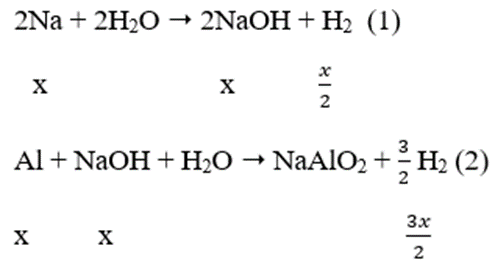
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)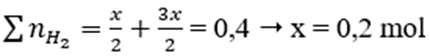
⇒ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
⇒ mAl = 0,2.27 = 5,4 (g)
Câu 29:
Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của NaOH trong dung dịch sau phản ứng.
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3 = 1.0,1 = 0,1 mol
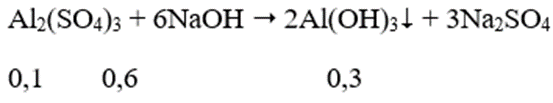
Vì NaOH dư nên:
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của Na[Al(OH)4]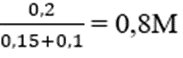
→ Đáp án C
Câu 30:
Thuốc thử dùng để nhận biết các dung dịch NaCl, CaCl2, MgCl2 là:
- Cho NaOH lần lượt vào các mẫu thử. Có kết tủa trắng là MgCl2
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
- Tiếp tục cho Na2CO3 vào 2 mẫu thử còn lại → Xuất hiện tủa trắng là CaCl2
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
→ Đáp án C
Câu 31:
Thực hiện các thí nghiệm sau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCl với điện cực trơ, có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí NH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
Các thí nghiệm điều chế được NaOH là:
Các thí nghiệm (II), (III) và (VI) điều chế được NaOH:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
2NaCl + 2H2O -đpdd c.m.n→ 2NaOH + H2 + Cl2
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
→ Đáp án B
Câu 32:
Hòa tan hoàn toàn một lượng hỗn hợp Na và K vào nước được dung dịch A và V lít khí ở đktc. Để trung hòa hòa toàn dung dịch A phải dùng 75 ml dung dịch H2SO4 0,5M. Vậy V có giá trị là:
Bài toán này có thể giải ngắn gọn như sau:
Số mol OH- tạo ra = số mol H+ trung hòa = 2. Số mol H2
Số mol H2 = 0,075 : 2 = 0,00375 → V = 0,84 lít
→ Đáp án C
Câu 33:
Hòa tan hoàn toàn 2,9g hỗn hợp gồm kim loại M và oxit của nó vào nước , thu được 500ml dd chứa một chất tan có nồng độ 0,04M, và 0,224l khí H2 (đktc). Kim loại M là
M: x mol; M2On: y mol
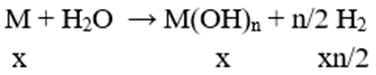
⇒ nx/2 = 0,01 ⇒ nx = 0,02
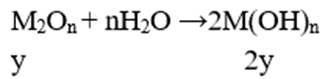
⇒ nM(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02; y = 0 ⇒ B.C loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01, y = 0,05
⇒ mhh = 0,01.M + 0,05.(2M + 16.2) = 2,9
⇒ M = Ba
→ Đáp án C
Câu 34:
Cho 3,9 gam hỗn hợp 2 muối Na2CO3 và K2SO3 tác dụng với 200 ml dung dịch HCl, ta thu được một hỗn hợp khí A có tỉ khối hơi so với metan là 3,583 và dung dịch B. Để trung hòa lượng axit còn dư trong dung dịch B ta phải dùng hết 100 ml dung dịch Ba(OH)2 0,2M. Vậy % Na2CO3 và K2SO3 trong hỗn hợp ban đầu là:
Gọi x, y là số mol cảu Na2CO3 và K2SO4 trong hỗn hợp.
Phương trình phản ứng xảy ra:
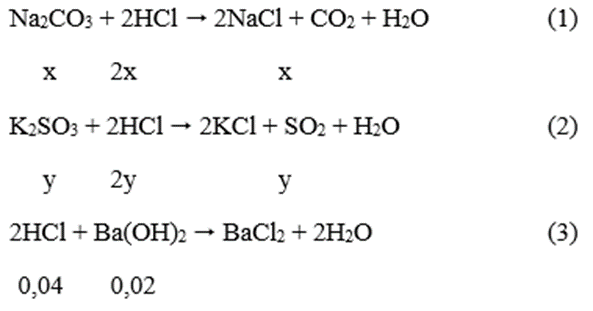
Theo đề bài ta có: 106x + 158y = 3,9 (I)
Mặt khác: (44x+16y)/(x+y) = 33,586.16 ⇒ -13,328x + 6,672y = 0 (II)
x = 0,00925 mol; y = 0,0185 mol

→ Đáp án D
Câu 35:
Cho 6,2 gam hỗn hợp gồm Na và một kim loại kiềm M có tỉ lệ số mol là 1:1 tác dụng với 104 gam nước, người ta thu được 110 gam dung dịch có khối lượng riêng là 1,1 g/ml. Vậy kim loại kiềm M là:
Phương trình phản ứng
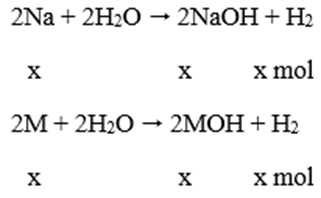
Theo đề bài ta có: 23x + Mx = 6,2 (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mkim loại + mnước = mdd + mhiđro
Từ đó: mhiđro = mkim loại - mnước = mdd = 6,2 + 104 - 110 = 0,2 (g)
→ x = 0,1 mol, thay vào (1) ta được M = 39 (K)
→ Đáp án B
Câu 36:
Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 ↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
→ Đáp án D
Câu 37:
Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
Ta có: nOH- = nNaOH = 0,7 mol
nAl3+= 2.0,1 = 0,2 mol
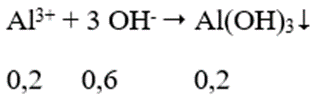
→ nOH- dư = 0,7 - 0,6 = 0,1 mol
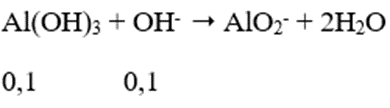
→ nAl(OH)3 = 0,2 - 0,1 = 0,1 mol
→ Đáp án CCâu 38:
Trộn 0,81 gam bột Al với bột Fe2O3 và CuO rồi nung nóng để tiến hành phản ứng nhiệt nhôm, thu được hỗn hợp X. Hòa tan X trong dung dịch HNO3 loãng, nóng, thu được V lit khí NO (đktc). Giá trị của V là:
Ta có: nAl = 0,03 (mol)
Các phương trình phản ứng:
2Al + Fe2O3 → Al2O3 + 2Fe (1)
2Al + 3CuO → Al2O3 + 3Cu (2)
Gọi số mol Al tham gia phản ứng (1) là x, tham gia phản ứng (2) là y.
Theo (1): nFe = nAl = x (mol)
Theo (2): nCu = 3/2 nAl = 3/2.y (mol)
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O (3)
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O (4)
Theo (3): nNO/(3) = nFe = x (mol).
Theo (4): nNO/(4) = 2/3 nCu = 2x/3. 3x/2 .y = y(mol)
⇒ nNO = x + y = 0,03 (mol) ⇒ VNO = 0,03 x 22,4 = 0,672 (lit).
→ Đáp án D
Câu 39:
Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là:
Ta có: nCO2 = 0,15 mol; nBa(OH)2 = 0,125 mol; nOH-= 0,25 mol
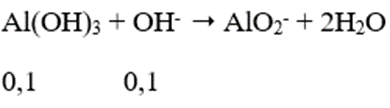
Phương trình phản ứng
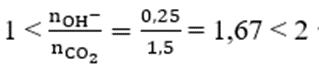
⇒ [Ba(HCO3)2] = 0,025/0,125 = 0,2M
→ Đáp án B
Câu 40:
Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
Hướng dẫn giải:
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
→ Đáp án B
