Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 9)
-
2793 lượt thi
-
36 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Đáp án đúng là: C
NaHCO3không tác dụng với CO2.
NaHCO3+ HCl → NaCl + CO2+ H2O
NaHCO3+ NaOH → Na2CO3+ H2O
2NaHCO3+ 2KOH → Na2CO3+ K2CO3+ 2H2O
Câu 2:
Đáp án đúng là: D
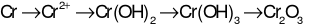


Câu 3:
Đáp án đúng là: D
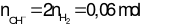
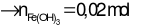
→ m = 0,02. 107 = 2,14 gam
Câu 4:
D. NaHCO3
Đáp án đúng là: B
AlCl3không có tính lưỡng tính.
Câu 5:
Đáp án đúng là: D
2Al + Cr2O3→ Al2O3+ 2Cr
Theo lí thuyết:
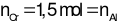
Do H = 90% nên: 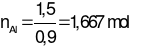
→ mAl= 45g
Câu 6:
Đáp án đúng là: B
Hai chất được dùng để làm mềm nước cứng vĩnh cửu là Na2CO3và Na3PO4
Câu 7:
Đáp án đúng là: B
B sai, ăn mòn hóa học không phát sinh dòng điện; ăn mòn điện hóa học mới phát sinh dòng điện.
Câu 8:
Đáp án đúng là: C
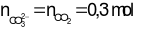
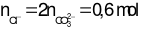
→ mKL= 32,3 – 0,6.35,5 = 11 gam
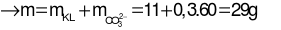
Câu 10:
Đáp án đúng là: C
K, Na tác dụng với H2O hay với H2SO4đều sinh H2như nhau nên 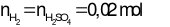
→ V = 0,448 lít
Câu 11:
Đáp án đúng là: D
2Al + 2NaOH + 2H2O → 2NaAlO2+ 3H2
Câu 12:
Đáp án đúng là: A
Các trường hợp thu được kết tủa là: FeCl3, CuCl2, FeSO4
Chú ý: Al(OH)3tan trong NaOH dư.
Câu 13:
Đáp án đúng là: B
CO2+ Ca(OH)2dư → CaCO3(↓ trắng) + H2O
Câu 14:
Đáp án đúng là: A
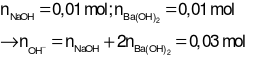
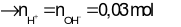
→ nHCl= 0,03 mol → VHCl= 0,1 lít = 100 ml
Câu 15:
Đáp án đúng là: C
Thêm lượng dư NaOH vào dung dịch K2Cr2O7thì dung dịch chuyển từ màu da cam sang màu vàng.
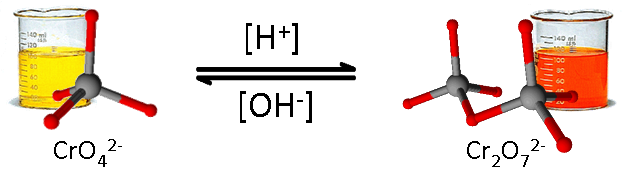
Câu 16:
D. Ba(NO3)2và K2SO4
Đáp án đúng là: C
X là Ba(NO3)2và Y là Na2CO3
Ba(NO3)2+ Na2CO3→ BaCO3↓ + 2NaNO3
Chú ý: Na2CO3là muối tạo bởi kim loại mạnh và gốc axit yếu nên bị thủy phân tạo môi trường bazơ.
Câu 17:
Đáp án đúng là: D
Có 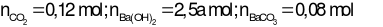
Vì  nên sản phẩm sau phản ứng gồm BaCO3và Ba(HCO3)2
nên sản phẩm sau phản ứng gồm BaCO3và Ba(HCO3)2
Áp dụng định luật bảo toàn nguyên tố cho C ta có:

Do đó 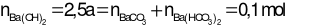
→ a = 0,04
Câu 18:
Đáp án đúng là : A
Khí SO2và NO2đều là nguyên nhân gây mưa axit
Câu 19:
Đáp án đúng là: A
TH1: Ba(OH)2dư, CO2hết
Ba(OH)2+ CO2→ BaCO3↓+ H2O
0,1 ← 0,1mol
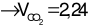 lít
lít
TH2: Ba(OH)2hết, CO2dư nhưng không hòa tan hết kết tủa
Ba(OH)2+ CO2→ BaCO3+ H2O
0,1 ← 0,1 ← 0,1mol
Ba(OH)2+ 2CO2→ Ba(HCO3)2
(0,3 - 0,1)→ 0,4
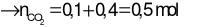
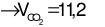 lít
lít
Câu 20:
Đáp án đúng là: D
Để khử ion Fe3+trong dung dịch thành ion Fe2+có thể dùng một lượng dư kim loại Cu
Cu + 2Fe3+→ Cu2++ 2Fe2+
Câu 21:
Đáp án đúng là: B
Hai kim loại Al và Cu đều phản ứng được với dung dịch HNO3loãng.
Al + 4HNO3→ Al(NO3)3+ NO + 2H2O
3Cu + 8HNO3→ 3Cu(NO3)2+ 2NO + 4H2O
Câu 22:
Đáp án đúng là: C
Bảo toàn nguyên tố Fe: 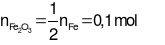
Bảo toàn nguyên tố Mg: nMgO= nMg= 0,1 mol
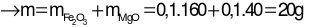
Câu 23:
Đáp án đúng là: A
Bảo toàn e: 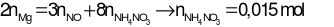
→ mmuối 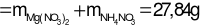
Câu 24:
Đáp án đúng là: D
Al và Cr giống nhau ở điểm cùng bị thụ động trong HNO3đặc, nguội.
Câu 25:
Đáp án đúng là: B
Ta có: 
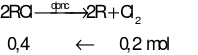
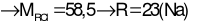
Câu 26:
Đáp án đúng là: B
Bảo toàn nguyên tố Ba: 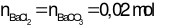
→ V = 0,01 lít
Câu 27:
Đáp án đúng là: B
Be không khử được nước ở nhiệt độ thường.
Câu 28:
D. ZnSO4
Đáp án đúng là: D
Chất không có tính lưỡng tính là ZnSO4
Câu 29:
Đáp án đúng là: B
Để xử lý sơ bộ nước thải trên, người ta sử dụng Ca(OH)2, các ion kim loại nặng bị lắng xuống dưới dạng kết tủa:
Hg2++ 2OH-→ Hg(OH)2↓
Pb2++ 2OH-→ Pb(OH)2↓
Fe3++ 3OH-→ Fe(OH)3↓
Câu 30:
D. sự khử Fe2+và sự khử Cu2+
Đáp án đúng là: A
Fe có số oxi hóa tăng lên sau phản ứng nên đóng vai trò là chất khử, vậy Cu2+là chất oxi hóa.
Vậy trong phản ứng trên xảy ra sự oxi hoá Fe và sự khử Cu2+.
Câu 32:
Đáp án đúng là: C
Ta có sơ đồ:


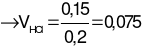 lít
lít
Phần 2. Tự luận
Câu 33:
Cho từ từ khí CO2đến dư vào dung dịch Ca(OH)2.
Cho từ từ đến dư dd NaOH vào dung dịch AlCl3.
Cho từ từ đến dư dd NH3vào dung dịch AlCl3.
Cho từ từ dd HCl đến dư vào dung dịch NaAlO2.
Cho từ từ khí CO2đến dư vào dung dịch NaAlO2.
Hướng dẫn giải
Các thí nghiệm sau khi kết thúc phản ứng thu được kết tủa: (c), (e).
3NH3+ AlCl3+ 3H2O → Al(OH)3↓ + 3NH4Cl
CO2+ NaAlO2+ 2H2O → NaHCO3+ Al(OH)3↓
Câu 34:
Hướng dẫn giải
Hiện tượng: Xuất hiện kết tủa trắng
Phương trình phản ứng:
Ca(OH)2+ Ca(HCO3)2→ 2CaCO3↓ + 2H2O
Câu 35:
Hướng dẫn giải
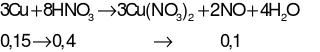
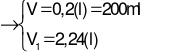
Câu 36:
Hướng dẫn giải
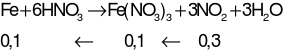
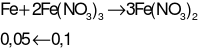
→ m = 56(0,1 + 0,05) + 2,4 = 10,8 gam
Cho khối lượng nguyên tử (u): H=1, C=12, N=14, O=16, Mg=24, Al=32S=32, Cl=35,5, K=39, Ca=40, Cr=52, Fe=56, Cu=64, Zn=65, Rb=85, Ba=137.
---Hết---
Ghi chú: Học sinh không được sử dụng tài liệu và bảng tuần hoàn.
Giám thị coi kiểm tra không giải thích gì thêm.
