Bộ đề thi học kì 2 Hóa 12 có đáp án (Mới nhất) - Đề số 4
-
1169 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Tính chất vật lý nào dưới đây của kim loại không phải do các electron tự do gây ra?
Chọn đáp án C.
Câu 2:
Dãy so sánh tính chất vật lý của kim loại nào dưới đây là không đúng?
Chọn đáp án D.
Câu 4:
Dãy các kim loại chỉ được điều chế bằng phương pháp điện phân nóng chảy là:
Chọn đáp án A.
Câu 6:
Để bảo vệ vỏ tàu biển ( bằng thép ) theo phương pháp điện hóa, người ta gắn vào mặt ngoài của vỏ tàu (phần ngâm dưới nước) khối kim loại nào sau đây?
Chọn đáp án A.
Câu 8:
Cho Mg vào dung dịch chứa FeSO4 và CuSO4. Sau khi phản ứng kết thúc thu được chất rắn A gồm 2 kim loại và dung dịch B chứa 2 muối. Phản ứng kết thúc khi nào?
Chọn đáp án A.
Câu 9:
Nhóm các kim loại nào sau đây đều tác dụng với nước ở nhiệt độ thường tạo dung dịch kiềm?
Chọn đáp án A.
Câu 14:
Dùng chất nào sau đây để phân biệt chất rắn đựng trong 3 lọ khác nhau: Mg; Al; Al2O3
Chọn đáp án C.
Câu 15:
Khi cho dung dịch KOH dư vào cốc đựng dung dịch Ca(HCO3)2 thì trong cốc:
Chọn đáp án B.
Câu 17:
Cho biết thứ tự từ trái sang phải của các cặp oxi hóa – khử trong dãy điện hóa (dãy thế điện cực chuẩn) như sau: Zn2+/Zn; Fe2+/Fe; Cu2+/ Cu; Fe3+/Fe2+; Ag+/Ag. Các kim loại và ion đều phản ứng được với ion Fe2+ trong dung dịch là
Dựa vào quy tắc α ta xác định được các cặp chất có phản ứng với Fe2+
Zn + Fe2+ → Zn2+ +Fe Fe2+ + Ag+ → Fe3+ + Ag
Chọn đáp án B.
Câu 18:
2 kim loại là Cu và Ag => Zn hết
=> Phương trình e:
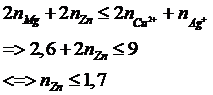
Chọn đáp án D.
Câu 19:
Hoà tan hoàn toàn 3,6 gam Mg bằng dung dịch chứa 0,42 mol HNO3 (vừa đủ). Sau phản ứng thu được dung dịch X và 0,56 lít hỗn hợp khí Y gồm N2O và N2 (đktc). Khối lượng muối trong X là:
Chọn đáp án D.
Câu 20:
Cho các chất sau : Al ; Na2CO3 ; Al(OH)3 ; (NH4)2CO3. Số chất trong dãy trên vừa tác dụng được với dung dịch HCl và tác dụng với dung dịch NaOH là :
Các chất : Al, Al(OH)3, (NH4)2CO3
Chọn đáp án A.
Câu 21:
Nung một hỗn hợp bột gồm Cr, Cu, Ag trong oxi dư đến hoàn toàn, sau phản ứng thu được chất rắn A. Cho A vào dung dịch HCl dư đun nóng thu được dung dịch X và kết tủa Y. Thành phần của kết tủa Y là
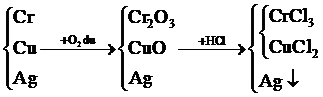
Chọn đáp án C.
Câu 22:
Cho dung dịch FeCl3 vào dung dịch chất X thu được kết tủa Fe(OH)3. Chất X là:
Chọn đáp án A.
Câu 23:
Chọn đáp án A,
Câu 24:
Chọn đáp án B.
Câu 25:
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân ![]()
(b) Đốt cháy ![]() trong khí O2 (xúc tác Pt);
trong khí O2 (xúc tác Pt);
(c) Sục khí ![]() vào dung dịch
vào dung dịch ![]()
Số thí nghiệm xảy ra phản ứng oxi hoá - khử là
không phản ứng
chỉ có (a) và (b) là phản ứng oxi hoá - khử
Chọn đáp án B.
Câu 26:
Cho các chất sau: Fe, FeO, Fe2O3, Fe3O4, Fe(NO3)2, FeS2, FeCO3, Fe(OH)2, Fe(OH)3, Fe(NO3)3 lần lượt tác dụng với dung dịch HNO3 loãng. Số phương trình phản ứng oxi hóa – khử là
Các phản ứng oxi hóa khử xảy ra giữa HNO3 với các chất: Fe, FeO, Fe3O4, Fe(NO3)2, FeS2, FeCO3, Fe(OH)2
Chọn đáp án A.
Câu 27:
Khi cho hỗn hợp Fe và Mg vào dd AgNO3 các phản ứng xảy ra theo thứ tự:
Sau khi pư xảy ra hoàn toàn thu được chất rắn Y gồm 2 kim loại là Ag và Fe còn dư.
→ ion Ag+ pư hết. Vậy 2 muối trong dd X là Mg(NO3)2 và Fe(NO3)2
Chọn đáp án A.
Câu 28:
Thực hiện các thí nghiệm sau:
(1) Thả một đinh Fe vào dung dịch HCl.
(2) Thả một đinh Fe vào dung dịch Cu(NO3)2.
(3) Thả một đinh Fe vào dung dịch FeCl3.
(4) Nối một dây Ni với một dây Fe rồi để trong không khí ẩm.
(5) Đốt một dây Fe trong bình kín chứa đầy khí O2.
(6) Thả một đinh Fe vào dung dịch chứa CuSO4 và H2SO4loãng.
Trong các thí nghiệm trên thì thí nghiệm mà Fe không bị ăn mòn điện hóa học là
(1) (3) (5) : Không có 2 điện cực khác bản chất
Chọn đáp án B.
Câu 29:
Cho m gam hỗn hợp X gồm CuO, Fe2O3, FeO tác dụng vừa đủ với 100ml dung dịch hỗn hợp H2SO4 1M và HCl 1M. Thể tích hỗn hợp khí CO và H2 tối thiểu ở điều kiện tiêu chuẩn cần để khử hoàn toàn m gam hỗn hợp X là
nH+ = 0,1 . 1. 2 + 0,1 . 1 = 0,3 mol
Vậy nO2- = 0,15 mol → V = 3,36 lít
Chọn đáp án A.
Câu 30:
Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lít (đktc) hỗn hợp khí X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là
Dung dịch chứa
Bảo toàn H → nH2O = 0,16 – 0,01.2 = 0,14
