Bộ đề thi học kì 2 Hóa 12 có đáp án (Mới nhất) - Đề số 7
-
1166 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm:
Chọn đáp án C.
Câu 2:
Để làm sạch loại thủy ngân có lẫn tạp chất là Zn,Sn,Pb cần khuấy loại thủy ngân này trong:
Chọn đáp án B.
Câu 4:
Để phân biệt các khí CO, CO2 ,O2 ,và SO2 có thể dùng
- Tàn đóm cháy dở: bình làm tàn đóm bùng cháy là O2
- Nước brom: SO2 làm mất màu
- Nước vôi trong: CO2 làm đục nước vôi trong
Chọn đáp án D.
Câu 6:
Lớp ozon ở tầng bình lưu của khí quyển là tấm lá chắn tia tử ngoại của Mặt trời, bảo vệ sự sống trên Trái đất. Hiện tượng suy giảm tầng ozon đang là một vấn đề môi trường toàn cầu. Nguyên nhân của hiện tượng này là do:
Chọn đáp án A.
Câu 8:
Chọn đáp án D.
Câu 10:
Các cặp có phản ứng xảy ra là
Fe2(SO4)3 và H2S; NaOH đặc và SiO2; Na2ZnO2 và HCl
Chọn đáp án B.
Câu 12:
Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được:
Chọn đáp án C.
Câu 15:
Chọn đáp án A.
Câu 16:
Ion kim loại nào sau đây làm ngọn lửa đèn khí nhuốm màu vàng tươi ?
Chọn đáp án B.
Câu 17:
Chọn thuốc thử là dung dịch NaOH.
|
|
NH4Cl |
MgCl2 |
AlCl3 |
NaNO3 |
|
NaOH |
Khí mùi khai thoát ra |
Kết tủa màu trắng, không tan trong NaOH dư |
Kết tủa keo trắng, tan trong NaOHdư |
Không có hiện tượng gì |
Chọn đáp án D.
Câu 19:
Thứ tự một số cặp oxi hóa - khử trong dãy điện hóa như sau: Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Cặp chất không phản ứng với nhau là
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Cu + 2FeCl3 → 2FeCl2 + CuCl2
Fe + CuCl2 → FeCl2 + Cu
Fe3+ không tác dụng được với Ag+
Chọn đáp án C.
Câu 20:
M + H2SO4 → MSO4 + H2 (1)
2KOH + H2SO4 → K2SO4 + 2H2O (2)
Mà
M là Magie
Chọn đáp án A.
Câu 21:
Cho m gam hỗn hợp X gồm Mg, Na, K và Ba vào dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 5,04 lít H2 (đktc). Cô cạn toàn bộ dung dịch Y thu được 29,475 gam hỗn hợp muối khan. Giá trị của m là
Phương pháp:
BTNT H: nHCl pư = 2nH2
BTKL: m + mHCl = m muối + mH2 =>m
Hướng dẫn giải:
BTNT H: nHCl pư = 2nH2 = 0,45 mol
BTKL: m + mHCl = m muối + mH2 => m + 0,45.36,5 = 29,475 + 0,225.2
=> m = 13,5 gam
Chọn đáp án A.
Câu 22:
Chọn đáp án C.
Câu 23:
Cho m gam Mg vào dung dịch có chứa 0,8 mol Fe(NO3)3 và 0,05 mol Cu(NO3)2, đến phản ứng hoàn toàn thu được 14,4 gam chất rắn.Giá trị của m là:
Chất rắn sau phản ứng gồm : Cu ( 0,05 mol => m = 3,2 gam ) và Fe ( 11,2 gam => n = 0,2 mol )
=> dung dịch sau phản ứng chứa : Mg2+ ; Fe2+ ( 0,6 mol ) và NO3- ( 2,5 mol)
=> Theo BTĐT : nMg2+ = 0,65 mol => mMg = 15,6 gam
Chọn đáp án A.
Câu 25:
Khử m gam hỗn hợp A gồm các oxit CuO; Fe3O4; Fe2O3 bằng khí CO ở nhiệt độ cao, người ta thu được 40 gam hỗn hợp chất rắn X và 13,2 gam khí CO2. Giá trị của m là
Phản ứng: m gam hỗn hợp oxit + CO → 40 gam chất rắn X + 0,3 mol CO2.
có nCO = nCO2 = 0,3 mol ⇒ BTKL có: m = 40 + 0,3 × 16 = 44,8 gam.
Chọn đáp án A.
Câu 26:
Cho các thí nghiệm sau:
(1) Để một miếng gang (Fe – C) ngoài không khí ẩm.
(2) Nhúng một thanh Fe vào dung dịch FeCl3.
(3) Nhúng một thanh Cu vào dung dịch FeCl3.
(4) Nhúng một thanh Fe vào dung dịch CuSO4.
Số thí nghiệm xảy ra ăn mòn điện hoá là:
Thí nghiệm xảy ra ăn mòn điện hóa là: (1); (4).
Chọn đáp án B.
Câu 27:
Chọn đáp án D.
Câu 29:
Hỗn hợp X gồm Fe và Cu có khối lượng là 42 gam. Chia X thành hai phần không bằng nhau.
Phần 1: cho tác dụng với dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc).
Phần 2: Cho tác dụng với dung dịch HNO3 đặc, nóng dư, thì có 2,5 mol HNO3 đã phản ứng, sau phản ứng hoàn toàn, thu được dung dịch chứa m gam hỗn hợp muối.
Giá trị của m là
* Phần 1: nFe = nH2 = 0,1; nCu = a
* Phần 2: nNO2 = 1,25; nFe = 0,1k và nCu = ak
Ta có hệ
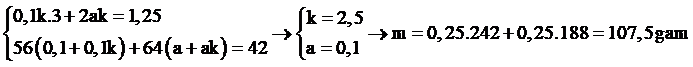
Câu 30:
Điện phân hỗn hợp 0,2 mol NaCl và a mol Cu(NO3)2 sau một thời gian thu được dung dịch X và khối lượng dung dịch X giảm 21,5. Cho thanh sắt vào dung dịch X đến phản ứng hoàn toàn thấy khối lượng thanh sắt giảm 2,6 gam và thoát ra khí NO duy nhất. Tính a?
n Cl- = 0,2 mol => n Cl2 = 0,1 mol
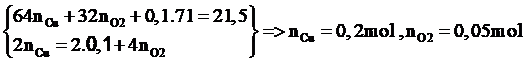
2 H2O → 4 H+ + O2 + 4 e
n O2 = 0,05 mol => n H+ = 0,2 mol = n HNO3
Fe + 4 HNO3→ Fe(NO3)3 + 2 H2O + NO
0,05 <= 0,2 => 0,05
Fe + 2 Fe(NO3)3 → 3 Fe(NO3)2
0,025 <=0,05
=> m Fe = 56 . ( 0,025 + 0,05 ) = 4,2 gam > 2,6 gam
=> có phản ứng của Fe với muối Cu2+
Fe + Cu(NO3)2→ Fe(NO3)2 + Cu
=> m tăng của phản ứng = 4,2 – 2,6 = 1,6 g
=> n Cu(NO3)2 = 1,6 : (64 – 56 ) = 0,2 mol
Vậy tổng số mol = 0,2 + 0,2 = 0,4 molChọn đáp án C.
