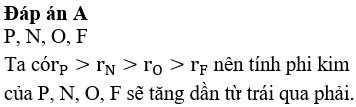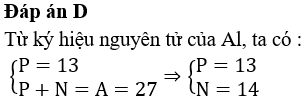NGUYÊN TỬ - BẢNG TUẦN HOÀN – LIÊN KẾT HÓA HỌC
-
20227 lượt thi
-
58 câu hỏi
-
80 phút
Danh sách câu hỏi
Câu 1:
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion
Đáp án B
NaF
NaF là hợp chất ion, hợp chất này được tạo bởi kim loại điển hình và phi kim điển hình. Các hợp chất CH4, H2O và CO2 là các hợp chất cộng hóa trị, các hợp chất này được tạo thành từ các nguyên tử phi kim.
Câu 2:
Cấu hình electron của ion Cu2+ và Cr3+ lần lượt là
Đáp án B
[Ar]3d9 và [Ar]3d3
Cấu hình electron của Cu và Cr lần lượt là [Ar]3d104s1 và [Ar]3d44s1. Suy ra cấu hình electron của Cu2+ và Cr3+ lần lượt là : [Ar]3d9 và [Ar]3d3.
Câu 3:
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
Đáp án D
chu kì 4, nhóm IA
Cation R+ có cấu hình electron 1s22s22p63s23p6. Suy ra R có cấu hình electron là 1s22s22p63s23p63s1.
Vậy R có Z = 11, nằm ở ô số 11, chu kì 4, nhóm IA
Câu 4:
Chất nào sau đây là hợp chất ion
Đáp án A
K2O
K2O là hợp chất tạo bởi kim loại điển hình và phi kim điển hình, suy ra liên kết giữa K và O trong hợp chất này là liên kết ion, hợp chất này là hợp chất ion.
Các hợp chất SO2, CO2, HCl được tạo bởi các nguyên tử phi kim bằng sự góp chung electron. Suy ra chúng là những hợp chất cộng hóa trị
Câu 5:
X, Y, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8. Nếu các cặp X và Y; Y và Z; X và Z tạo thành liên kết hoá học thì các cặp nào sau đây có liên kết cộng hoá trị phân cực
Đáp án B
Cặp X và Z
Dựa vào số đơn vị điện tích hạt nhân ta thấy : X, Z là các phi kim điển hình, Y là kim loại điển hình. Vậy liên kết giữa cặp X và Z là liên kết cộng hóa trị phân cực
Câu 6:
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
Đáp án C
6
Ở trạng thái cơ bản, nguyên tử X có 4 electron ở lớp L nên sự phân bố electron trên các lớp là 2/4. Suy ra X có 6 electron, 6 proton.
Câu 9:
Phát biểu nào sau đây là sai
Đáp án A
Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
Phát biểu sai là “Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim”.
Trong một chu kì, số lớp electron của các nguyên tử bằng nhau, nên theo chiều Z tăng thì sức hút của hạt nhân với các electron tăng dần, dẫn đến bán kính nguyên tử giảm dần. Điều đó có nghĩa là bán kính nguyên tử kim loại lớn hơn bán kính nguyên tử phi kim.
Các phát biểu còn lại đều đúng
Câu 12:
Liên kết hóa học trong phân tử thuộc loại liên kết
Đáp án D
cộng hóa trị không cực
Liên kết trong phân tử Br2 là liên kết giữa hai nguyên tử phi kim của cùng một nguyên tố, đó là liên kết cộng hóa trị không phân cực
Câu 15:
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Đáp án B
phi kim và kim loại
Nguyên tử nguyên tố Y có electron ở mức năng lượng 3p và có 1 electron ở lớp ngoài cùng, suy ra cấu hình electron của Y là 1s22s22p63s23p64s1. Nguyên tử X có electron ở mức năng lượng cao nhất là 3p và X, Y có số electron hơn kém nhau là 2, suy ra cấu hình electron của X là 1s22s22p63s23p5. Vậy X là phi kim vì có 5 electron ở lớp ngoài cùng, Y là kim loại vì có 1 electron ở lớp ngoài cùng
Câu 17:
Cấu hình electron của nguyên tử Ca (Z= 20) ở trạng thái cơ bản là
Đáp án C
1s22s22p63s23p64s2.
Với Z = 20, suy ra số electron của nguyên tử Ca bằng 20. Vậy cấu hình electron của nguyên tử Ca là :
1s22s22p63s23p64s2.
Câu 21:
Phát biểu nào dưới đây không đúng
Đáp án B
Với mọi nguyên tử, khối lượng nguyên tử bằng số khối
Phát biểu không đúng là “Với mọi nguyên tử, khối lượng nguyên tử bằng số khối”.
Số khối hạt nhân là tổng số hạt proton và nơtron của nguyên tử.
Khối lượng nguyên tử là tổng khối lượng của các hạt proton, nơtron và electron. Khối lượng nguyên tử có thể tính theo đơn vị gam, kg hoặc đơn vị cacbon (đvC hay u). Nếu tính theo đơn vị đvC thì khối lượng nguyên tử (nguyên tử khối) cũng chỉ xấp xỉ bằng số khối.
Các phát biểu còn lại đều đúng.
Câu 22:
Cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
Đáp án A
chu kì 4, nhóm VIIIB
Từ cấu hình electron của X2+, suy ra cấu hình electron của X là 1s22s22p63s23p63d64s2. Với cấu hình electron này thì X là Fe, thuộc ô 26, nhóm VIIIB, chu kì 4.
Câu 23:
Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là
Đáp án C
H2O, HF, H2S
Liên kết cộng hóa trị có cực được tạo bởi hai phi kim khác nhau hoặc giữa kim loại và phi kim mà hiệu độ âm điện của chúng nhỏ hơn 1,77. Suy ra dãy gồm các chất trong phân tử chỉ chứa liên kết cộng hóa trị phân cực là H2O, HF, H2S.
Câu 25:
Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị không cực là
Đáp án A
Liên kết cộng hóa trị không cực được hình thành bởi hai nguyên tử phi kim giống nhau. Trong dãy chất trên có 2 chất mà phân tử chỉ có liên kết cộng hóa trị không cực là N2 và H2.
Câu 27:
Nhận định nào sau đây đúng khi nói về 3 nguyên tử :
Đáp án B
X và Z có cùng số khối
Nhận định đúng là “X và Z có cùng số khối”.
Các nhận định còn lại đều sai.
X có Z = 13, Y có Z = 26 nên X và Y là hai nguyên tố hóa học khác nhau.
X có N = 13, Y có N = 29 nên X và Y có số N khác nhau.
X có Z = 13, Z có Z = 12 nên chúng là hai nguyên tố hóa học khác nhau.
Câu 28:
Liên kết hóa học giữa các nguyên tử trong phân tử HCl thuộc loại liên kết
Đáp án C
cộng hóa trị có cực
Phân tử HCl được hình thành từ hai nguyên tử phi kim có độ âm điện khác nhau.
Suy ra : Liên kết hóa học giữa các nguyên tử H và Cl trong phân tử HCl thuộc loại liên kết cộng hóa trị có cực.
Câu 29:
Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
Đáp án C
22
Cấu hình electron ở phân lớp ngoài cùng của R (ở trạng thái cơ bản) là 2p6. Suy ra cấu hình electron ở phân lớp ngoài cùng của R, ở trạng thái cơ bản là 3s1. Vậy R là Na (Z =11).
Tổng số hạt mang điện của Na bằng tổng số hạt proton và số electron của nó và bằng 22
Câu 31:
Cho độ âm điện của các nguyên tố: O (3,5), Na (0,9), Mg (1,2), Cl (3,0). Trong các phân tử sau, phân tử nào có độ phân cực lớn nhất
Đáp án C
MgO
Sự phân cực của liên kết hóa học giữa hai nguyên tử tỉ lệ thuận với hiệu độ âm điện của chúng. Suy ra trong các phân tử NaCl, MgCl2, MgO, Cl2O thì liên kết trong phân tử MgO có sự phân cực mạnh nhất.
Câu 36:
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
Đáp án D
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là 1s22s22p63s1
Câu 37:
Electron thuộc lớp nào sau đây liên kết kém chặt chẽ với hạt nhân nhất
Đáp án C
lớp N
Trong nguyên tử, lớp electron thứ nhất (lớp K) ở gần hạt nhân nhất nên liên kết với hạt nhân chặt chẽ nhất. Các lớp electron ở càng xa hạt nhân thì liên kết với hạt nhân càng kém chặt chẽ. Vậy trong 4 lớp K, L, M, N thì lớp N liên kết với hạt nhân kém chặt chẽ nhất.
Câu 38:
Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm VA. Công thức của hợp chất tạo thành 2 nguyên tố trên có dạng là
Đáp án A
X3Y2
Trong hợp chất giữa X và Y, X là kim loại ở nhóm IIA nên có số oxi hóa là +2. Vậy Y sẽ mang số oxi hóa âm. Y ở nhóm V sẽ nhận thêm 3 electron để tạo thành ion có số oxi hóa là –3. Suy ra hợp chất tạo bởi X và Y là X3Y2
Câu 39:
Liên kết hóa học giữa các nguyên tử trong phân tử NH3 là liên kết
Đáp án A
cộng hóa trị phân cực
Liên kết giữa nguyên tử N với 3 nguyên tử H trong phân tử NH3 là liên kết giữa các nguyên tử phi kim, đó là liên kết cộng hóa trị (1). Vì độ âm điện của N lớn hơn độ âm điện của H nên cặp electron dùng chung sẽ bị lệch về phía nguyên tử N (2). Từ (1) và (2) suy ra liên kết giữa các nguyên tử trong phân tử NH3 là liên kết cộng hóa trị phân cực
Câu 40:
Những câu sau đây, câu nào sai
Đáp án D
Nguyên tử của các nguyên tố cùng chu kỳ có số electron bằng nhauTrong các câu trên, câu sai là "Nguyên tử của các nguyên tố cùng chu kỳ có số electron bằng nhau". Phát biểu đúng phải là : Nguyên tử của các nguyên tố cùng chu kỳ có số lớp electron bằng nhau.
Các phát biểu còn lại đều đúng.
Câu 41:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
Đáp án D
Si (Z=14).
Theo giả thiết suy ra cấu hình electron của X là 1s22s22p63s23p2. Vậy X có Z = 14, đó là nguyên tố Si
Câu 43:
Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
Đáp án C
Bán kính nguyên tử giảm, độ âm điện tăng
Các nguyên tố từ Li đến F đều có 2 lớp electron, theo chiều điện tích hạt nhân tăng dần thì sức hút của hạt nhân tăng dần, dẫn đến bán kính nguyên tử giảm dần, độ âm điện tăng dần.
Câu 52:
Những câu sau đây, câu nào sai
Đáp án D
Trong các câu trên, câu sai là "Nguyên tử của các nguyên tố cùng chu kỳ có số electron bằng nhau". Phát biểu đúng phải là : Nguyên tử của các nguyên tố cùng chu kỳ có số lớp electron bằng nhau.
Các phát biểu còn lại đều đúng
Câu 54:
Trong một nhóm A (phân nhóm chính), trừ nhóm VIIIA (phân nhóm chính nhóm VIII), theo chiều tăng của điện tích hạt nhân nguyên tử thì
Đáp án D
tính phi kim giảm dần, bán kính nguyên tử tăng dần
Trong một nhóm A (phân nhóm chính), trừ nhóm VIIIA (phân nhóm chính nhóm VIII), theo chiều tăng của điện tích hạt nhân nguyên tử thì số lớp electron của các nguyên tử tăng lên, dẫn đến bán kính nguyên tử tăng dần, khả năng liên kết của electron lớp ngoài cùng với hạt nhân vì thế mà giảm dần, tính kim loại (khả năng nhường electron) tăng dần, tính phi kim (khả năng hút electron) giảm dần.
Câu 55:
Các chất mà phân tử không phân cực là
Đáp án B
Các chất mà phân tử không phân cực là các phân tử thẳng Cl2, CO2 và C2H2
Câu 56:
Hãy cho biết lớp N có thể chứa tối đa bao nhiêu electron
Đáp án D
Lớp N có 4 phân lớp 4s, 4p, 4d, 4f. Phân lớp s, p, d, f có số electron tối đa lần lượt là 2; 6; 10; 14. Suy ra lớp N có tối đa 32 electron.
Câu 57:
Tính chất axit của dãy các hiđroxit : H2SiO3, H2SO4, HClO4 biến đổi như thế nào
Đáp án A
Si, S và Cl đều thuộc chu kì 3. Đi từ Si đến Cl, khả năng nhận electron tăng dần, dẫn đến tính phi kim tăng dần. Suy ra tính axit của các chất H2SiO3, H2SO4, HClO4 cũng tăng dần.
Câu 58:
Mức độ phân cực của liên kết hoá học trong các phân tử được sắp xếp theo thứ tự giảm dần từ trái sang phải là
Đáp án A
HCl, HBr, HI.
Để đánh giá độ phân cực của liên kết giữa hai nguyên tử, người ta dựa vào hiệu độ âm điện của chúng. Hiệu độ âm điện càng lớn thì liên kết càng phân cực và ngược lại.
Trong nhóm VIIA, đi từ Cl đến I thì độ âm điện giảm dần. Suy ra độ phân cực của liên kết trong các hợp chất HCl, HBr, HI giảm dần.