Đề kiểm tra giữa học kì 2 Hóa 12 có đáp án (Mới nhất) (Đề 10)
-
2403 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Đáp án đúng là: B
S tác dụng với Hg ngay ở nhiệt độ thường.
Dùng bột S để khử độc Hg nếu chẳng may nhiệt kế thủy ngân bị vỡ.
Hg + S HgS.
Câu 2:
Đáp án đúng là: A
Kim loại Al vừa phản ứng với dung dịch HCl, vừa phản ứng với dung dịch NaOH.
Phương trình hóa học:
2Al + 6HCl 2AlCl3 + 3H2 ↑
Al + NaOH + H2O NaAlO2 + H2 ↑
Câu 3:
Khử hoàn toàn 24 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
Đáp án đúng là: D
Phương trình hóa học: CuO + CO Cu + CO2.
nCu = nCuO = 0,3 (mol).
m = mCu = 0,3×64 = 19,2 (gam).
Câu 4:
Đáp án đúng là: D
Phương trình hóa học: 2Al + 3Cl2 2AlCl3.
nAl = = 0,2 (mol).
m = mAl = 0,2×27 = 5,4 (gam).
Câu 5:
Hòa tan hoàn toàn 3,9 gam hỗn hợp Al và Mg trong dung dịch H2SO4 dư, thu được 4,48 lít khí H2 và dung dịch chứa m gam muối. Giá trị của m là
Đáp án đúng là: D
Sơ đồ phản ứng: hỗn hợp + H2SO4 Muối + H2.
= 0,2 (mol) = 0,2 (mol).
m = mmuối = m(Al, Mg) + = 3,9 + 0,2×96 = 23,1 (gam).
Câu 6:
Đáp án đúng là: D
Ở nhiệt độ thường, kim loại tồn tại ở trạng thái lỏng là Hg.
Câu 7:
Đáp án đúng là: D
Những tính chất vật lí chung của kim loại (tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim) chủ yếu do các electron tự do trong kim loại gây ra.
Một số tính chất vật lí của kim loại như khối lượng riêng, nhiệt độ nóng chảy, tính cứng phụ thuộc vào độ bền của liên kết kim loại, nguyên tử khối, kiểu mạng tinh thể … của kim loại.
Câu 8:
Đáp án đúng là: A
Muối X là MgSO4.
Phương trình hóa học: MgSO4 + 2NaOH Mg(OH)2¯ + Na2SO4.
Loại B vì: Ban đầu tạo kết tủa trắng keo, sau đó kết tủa tan hoàn toàn trong NaOH dư.
Al2(SO4)3 + 6NaOH 2Al(OH)3¯ + 3Na2SO4
Al(OH)3 + NaOH NaAlO2 + 2H2O
Loại C vì: Tạo kết tủa màu xanh.
CuSO4 + 2NaOH Cu(OH)2¯ + Na2SO4.
Loại D vì: Tạo kết tủa nâu đỏ.
FeCl3 + 3NaOH Fe(OH)3¯ + 3NaCl
Câu 9:
Đáp án đúng là: B
Be không tan trong nước ở nhiệt độ thường cũng như nhiệt độ cao.
Loại A, C, D vì: Na, K, Ba tan trong nước ở nhiệt độ thường tạo thành dung dịch bazơ.
2Na + 2H2O 2NaOH + H2 ↑
2K + 2H2O 2KOH + H2 ↑
Ba + 2H2O Ba(OH)2 + H2 ↑
Câu 10:
Nung hợp chất X trong không khí đến khối lượng không đổi, thu được Fe2O3 và H2O. Cho X vào dung dịch HNO3 đặc, nóng, có khí thoát ra. Hợp chất X là
Đáp án đúng là: B
Cho X vào dung dịch HNO3 đặc, nóng, có khí thoát ra.
X là hiđroxit sắt(II): Fe(OH)2.
Phương trình hóa học:
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Fe(OH)2 + 4HNO3 Fe(NO3)3 + NO2↑ + 3H2O
Câu 11:
Đáp án đúng là: A
Để tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO thì hợp chất sắt phải có số oxi hóa của Fe ≠ +3.
FeO tác dụng với dung dịch HNO3 loãng, dư sinh ra khí NO.
3FeO + 10HNO3 3Fe(NO3)3 + NO ↑ + 5H2O
Câu 12:
Đáp án đúng là: A
Tính chất hóa học đặc trưng của kim loại là tính khử.
M Mn+ + ne.
Câu 13:
Thuốc thử để phân biệt các mẫu hóa chất mất nhãn gồm: Na2CO3, HCl, NaHSO4 là
Đáp án đúng là: D
Phân biệt: Na2CO3, HCl, NaHSO4.
Dùng dung dịch Ba(HCO3)2.
+ Thấy có khí thoát ra là HCl.
Ba(HCO3)2 + 2HCl BaCl2 + 2CO2 ↑ + 2H2O
+ Thấy vừa có khí thoát ra, vừa xuất hiện kết tủa trắng là NaHSO4.
Ba(HCO3)2 + 2NaHSO4 Na2SO4 + BaSO4¯ + 2CO2 ↑ + 2H2O
+ Chỉ thấy xuất hiện kết tủa trắng là Na2CO3.
Ba(HCO3)2 + Na2CO3 BaCO3¯ + 2NaHCO3
Câu 14:
Đáp án đúng là: C
Phương trình hóa học không đúng: Cu + 2HCl → CuCl2 + H2.
Vì kim loại Cu không phản ứng với dung dịch HCl.
Câu 15:
Đáp án đúng là: A
Phương trình phản ứng đúng: Mg + CuSO4 → MgSO4 + Cu.
Loại B vì: 2Na + 2H2O → 2NaOH + H2 ↑;
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2¯.
Loại C vì: Fe + 2HCl → FeCl2 + H2↑
Loại D vì: Vì kim loại Cu không phản ứng với dung dịch H2SO4 loãng.
Câu 16:
Kim loại tác dụng với khí Cl2 và dung dịch HCl tạo cùng loại muối là
Đáp án đúng là: D
Kim loại Mg tác dụng với khí Cl2 và dung dịch HCl tạo cùng loại muối.
Mg + Cl2 MgCl2
Mg + 2HCl → MgCl2 + H2
Loại A vì: Kim loại Fe tác dụng với khí Cl2 và dung dịch HCl thu được hai muối khác nhau.
2Fe + 3Cl2 2FeCl3
Fe + 2HCl → FeCl2 + H2
Loại B vì: Cu không phản ứng với dung dịch HCl.
Loại C vì: Ag không phản ứng với dung dịch HCl.
Câu 17:
Chất nào sau đây không bị khử bởi CO ở nhiệt độ cao?
Đáp án đúng là: D
CO chỉ khử được oxit của kim loại có tính khử trung bình hoặc yếu như Zn, Cu, Fe, Ni, …
Câu 18:
(a) Các kim loại kiềm thường tồn tại dạng đơn chất trong tự nhiên.
(b) Có thể sử dụng vôi để làm mềm nước có tính cứng tạm thời.
(c) Trong công nghiệp, Al được điều chế từ nguyên liệu là đất sét
(d) Nhúng miếng Al vào dung dịch CuSO4 có xảy ra ăn mòn điện hóa học.
(e) Dùng dung dịch NaOH có thể phân biệt các chất rắn là MgO, Al2O3, Al.
Số phát biểu đúng là
Đáp án đúng là: D
Phát biểu đúng: (b), (d). (e).
Phát biểu (a) không đúng, vì: Kim loại kiềm dễ bị oxi hóa thành ion dương, do vậy trong tự nhiên kim loại kiềm chỉ tồn tại ở dạng hợp chất.
Phát biểu (c) không đúng, vì: Trong công nghiệp, Al được sản xuất từ quặng boxit (thành phần chính là Al2O3.2H2O).
Câu 19:
(1) Cho Zn vào dung dịch AgNO3;
(2) Cho Fe vào dung dịch Fe2(SO4)3;
(3) Cho Na vào dung dịch CuSO4;
(4) Dẫn khí CO (dư) qua bột CuO nóng.
Các thí nghiệm không tạo thành kim loại là
Đáp án đúng là: A
(1) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
(2) Fe + Fe2(SO4)3 → 3FeSO4
(3) Cho Na vào dung dịch CuSO4:
2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2¯
(4) CO + CuO Cu + CO2
Câu 20:
Đáp án đúng là: A
= 0,2 (mol); nNaOH = 0,4 (mol).
Nhận xét: = 2 → Chỉ tạo muối Na2CO3 (CO2 và NaOH phản ứng vừa đủ).
Phương trình hóa học:
CO2 + 2NaOH → Na2CO3 + H2O
0,2 0,4 0,2 (mol)
Câu 21:
Cho các dung dịch loãng: (1) FeCl3, (2) AgNO3, (3) H2SO4 loãng, (4) HCl, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với kim loại Cu là:
Đáp án đúng là: C
Những dung dịch phản ứng được với kim loại Cu là: (1), (2), (5).
(1) Cu + 2FeCl3 → CuCl2 + 2FeCl2
(2) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(5) 3Cu + 8H+ + 2 → 3Cu2+ + 2NO + 4H2O
Câu 22:
Quá trình xảy ra tại các điện cực khi điện phân dung dịch AgNO3 là
Đáp án đúng là: A
Quá trình điện phân:|
Cực âm (-): Ag+, H2O |
Cực dương (+):, H2O |
|
Ag+ + 1e → Ag (Sự khử ion Ag+) |
2H2O → O2 + 4H+ + 4e |
Câu 23:
Đáp án đúng là: A
Phương trình hóa học: Fe + CuSO4 → FeSO4 + Cu.
nFe = nCu = 0,15 (mol).
Câu 24:
Đáp án đúng là: A
Sơ đồ phản ứng: Oxit + H2 → Rắn + CO2.
Câu 25:
Sục khí CO2 dư vào dung dịch Ca(OH)2 sẽ có hiện tượng gì xảy ra?
Đáp án đúng là: D
Sục khí CO2 dư vào dung dịch Ca(OH)2:
Hiện tượng: Xuất hiện kết tủa trắng sau đó kết tủa tan dần.
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3¯ + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Câu 26:
Điện phân đến hết 0,2 mol Cu(NO3)2 trong dung dịch với điện cực trơ, thì sau điện phân khối lượng dung dịch đã giảm bao nhiêu gam?
Đáp án đúng là: B
Quá trình điện phân:|
Catot (-): Cu2+, H2O |
Anot (+): , H2O |
|
Cu2+ + 2e → Cu 0,2 0,4 0,2 (mol) |
2H2O → O2 + 4H+ + 4e 0,1 0,4 (mol) |
Câu 27:
Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Nhúng thanh Zn vào dung dịch AgNO3.
- Thí nghiệm 2: Nhúng thanh Ag vào dung dịch CuSO4.
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3.
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl;
- Thí nghiệm 5: Đốt dây thép (Fe, C) trong khí Cl2.
Số trường hợp xuất hiện ăn mòn điện hóa là
Đáp án đúng là: C
Điều kiện xảy ra ăn mòn điện hóa;
+ Các điện cực phải khác nhau về bản chất.
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn.
+ Các điện cực cùng tiếp xúc với dung dịch chất điện li.
- Thí nghiệm 1: Nhúng thanh Zn vào dung dịch AgNO3.
Zn + 2AgNO3 → Zn (NO3)2 + 2Ag
- Thí nghiệm 2: Nhúng thanh Ag vào dung dịch CuSO4.
Ag + CuSO4 → Không phản ứng
- Thí nghiệm 3: Nhúng thanh Cu vào dung dịch FeCl3.
Cu + 2FeCl3 → CuCl2 + 2FeCl2
- Thí nghiệm 4: Cho thanh Fe tiếp xúc với thanh Cu rồi nhúng vào dung dịch HCl.
Xuất hiện cặp điện cực Fe – Cu → Xảy ra ăn mòn điện hóa.
- Thí nghiệm 5: Đốt dây thép (Fe, C) trong khí Cl2.
Vậy: Thí nghiệm (1) và thí nghiệm (4) xảy ra ăn mòn điện hóa.
Câu 28:
Đáp án đúng là: C
nZn = 0,2 (mol); = 0,02 (mol)
Nhận xét: 2nZn = 0,4 ≠ 8 = 0,16 → Có muối NH4NO3 trong dung dịch.
Bảo toàn e: 2nZn = 8 + 8→ = 0,03 (mol).
mmuối = = 0,2×189 + 0,03×80 = 40,2 (gam).
Câu 29:
Đáp án đúng là: C
= 0,5 (mol).
Tính khử: Zn > Fe → Thứ tự kim loại phản ứng với dung dịch CuSO4: Zn, Fe.
Khối lượng kim loại tăng sau phản ứng → Fe có tham gia phản ứng với dung dịch CuSO4.
Nếu CuSO4 phản ứng hoàn toàn thì: mCu = 0,5×64 = 32 < 43,2 → Kim loại Fe còn dư sau phản ứng.
mFe (dư) = 43,2 – 32 = 11,2 (gam).
Phương trình hóa học:
Zn + CuSO4 → ZnSO4 + Cu
x x x (mol)
Fe + CuSO4 → FeSO4 + Cu
y y y (mol)
Gọi nZn = x (mol); nFe(pư) = y (mol)
mKL tăng = 64×(x + y) – (65x + 56y) = 43,2 – 41 = 2,2
Ta có: 65x + 56y + 11,2 = 41 (**)
Từ (*) và (**), suy ra: x = 0,2; y = 0,3.
Câu 30:
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch Ba(HCO3)2 vào dung dịch KHSO4.
(b) Cho Fe vào dung dịch CuSO4 dư.
(c) Cho dung dịch (NH4)2CO3 vào dung dịch Ba(OH)2.
(d) Cho NaOH tới dư vào dung dịch FeCl3.
(e) Cho dung dịch NaOH vào dung dịch H2SO4.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả chất rắn và khí là
Đáp án đúng là: B
(a) Ba(HCO3)2 + 2KHSO4 → BaSO4 + K2SO4 + 2CO2 ↑ + 2H2O.
(b) Fe + CuSO4 → FeSO4 + Cu.
(c) (NH4)2CO3 + Ba(OH)2 → BaCO3+ 2NH3↑ + 2H2O.
(d) 3NaOH + FeCl3 → 3NaCl + Fe(OH)3.
(e) 2NaOH + H2SO4 → Na2SO4 + 2H2O.
Câu 31:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Na, K2O, Ba và BaO (trong đó oxi chiếm 20% về khối lượng) vào nước, thu được 300 ml dung dịch Y và 0,336 lít khí H2. Trộn 300 ml dung dịch Y với 200 ml dung dịch gồm HCl 0,2M và HNO3 0,3M, thu được 500 ml dung dịch có pH = 13. Giá trị của m là
Đáp án đúng là: A
Sơ đồ phản ứng: X + H2O → Y + H2.
= 0,015 (mol).
Bào toàn nguyên tử H: (*).
nHCl = 0,04 (mol); = 0,06 (mol)
H+ + OH- → H2O (1)
0,1 0,1 (mol)
Sau phản ứng: pH = 13 → pOH = 14 – 13 = 1 → [OH]- = 0,1M
Thay vào (*), ta có: 2 = 0,15+ 2×0,015 → = 0,09 (mol).
Bảo toàn nguyên tố O: nO(X) + =
Ta có: %mO(X) = = 20%
Câu 32:
Đáp án đúng là: D
Sơ đồ phản ứng: X + H2SO4 → Muối + H2.
= 0,06 (mol) = → = 0,06 (mol).
Câu 33:
Cho 100 ml dung dịch FeCl2 1M tác dụng với 200 ml dung dịch AgNO3 4M, thu được m gam kết tủa. Giá trị của m là
Đáp án đúng là: D
= 0,1 (mol) → = 0,1 (mol); = 0,2 (mol).
= 0,8 (mol) → = = 0,8 (mol).
Phương trình hóa học:
Fe2+ + Ag+ → Fe3+ + Ag (tính theo )
0,1 0,1 0,1 (mol)
Ag+ + Cl- → AgCl (tính theo )
0,2 0,2 0,2 (mol)
Câu 34:
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch NaOH vào dung dịch Ba(HCO3)2.
(b) Cho dung dịch NH3 đến dư vào dung dịch AlCl3.
(c) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(d) Cho dung dịch AgNO3 vào dung dịch MgCl2.
(e) Cho Mg vào dung dịch FeCl3 dư.
(f) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kết tủa là
Đáp án đúng là: B
(a) 2NaOH + Ba(HCO3)2 → BaCO3 + Na2CO3 + 2H2O.
(b) 3NH3 + AlCl3 + 3H2O → Al(OH)3 + 3NH4Cl.
Al(OH)3 không tan trong NH3 dư.
(c) CO2 + Ca(OH)2 → CaCO3 + H2O.
(d) 2AgNO3 + MgCl2 → 2AgCl + Mg(NO3)2.
(e) Mg + 2FeCl3 dư → MgCl2 + 2FeCl2.
(f) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag.
Câu 35:
Hoà tan a gam hỗn hợp bột Fe, Al bằng dung dịch HCl thu được 17,92 lit khí H2. Cùng lượng hỗn hợp trên hoà tan trong dung dịch NaOH dư thu được 13,44 lít khí H2. Giá trị của a là
Đáp án đúng là: C
Tác dụng với dung dịch HCl: = 0,8 (mol).
Bảo toàn e: 2nFe + 3nAl = 2 → 2nFe + 3nAl = 1,6 (1).
Tác dụng với dung dịch NaOH: = 0,6 (mol).
Bảo toàn e: 3nAl = 2 → nAl = 0,4 (mol)
Câu 36:
Cho m gam hỗn hợp X gồm Na và Al vào nước thu được dung dịch X; 5,376 lit H2 và 6,75 gam chất rắn không tan. Nếu oxi hoá m gam X cần V lít khí Cl2. Giá trị của V là
Đáp án đúng là: D
Cho hỗn hợp X (Na, Al) vào nước:
Na + H2O → NaOH + ![]() H2
H2
x x 0,5x (mol)
NaOH + Al + H2O → NaAlO2 + ![]() H2
H2
x x 1,5x (mol)
= 0,24 (mol); mAl (dư) = 6,75 (gam) → nAl (dư) = 0,25 (mol).
Gọi nNa = x (mol).
Vậy trong X: nNa = 0,12 (mol); nAl = 0,12 + 0,25 = 0,37 (mol).
Oxi hoá m gam X bằng khí Cl2:
Bảo toàn e: nNa + 3nAl = 2 → = 0,615 (mol).
Câu 37:
Cho m gam hỗn hợp X gồm Al và Al2O3 tác dụng với dung dịch NaOH dư, thì có 0,5 mol NaOH đã phản ứng, sau phản ứng thu được 3,36 lít khí H2. Giá trị của m là
Đáp án đúng là: B
Phương trình hóa học:
Al + NaOH + H2O → NaAlO2 + ![]() H2
H2
0,1 0,1 0,15 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,2 0,4 (mol)
= 0,15 (mol).
Câu 38:
Cho khí CO dư đi qua 24 gam hỗn hợp X gồm CuO, Fe2O3 và MgO nung nóng, thu được m gam chất rắn Y và hỗn hợp khí Z. Dẫn từ từ toàn bộ khí Z vào 0,2 lít dung dịch gồm Ba(OH)2 1M và NaOH 1M, thu được 29,55 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
Sơ đồ phản ứng: X + CO(dư) → Rắn Y + Z .
Bản chất phản ứng: CO + [O] → CO2.
= 0,2 (mol); nNaOH = 0,2 (mol); (mol)
Ta có đồ thị sau:
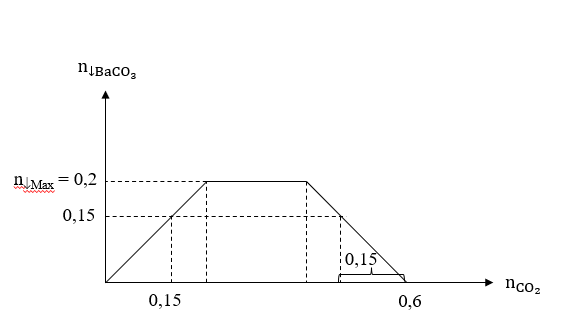
Trường hợp 1: = 0,15 (mol).
Trường hợp 2: = 0,6 – 0,15 = 0,45 (mol).
→ Giá trị của m gần nhất với 17.
Câu 39:
Đáp án đúng là: D
Ta có hệ phương trình:
= 0,015 (mol); = 0,06 (mol).
→ = 0,015×2 + 0,06 = 0,09 (mol); = 0,06 (mol).
Để hòa tan được hết hỗn hợp kim loại thì:
Bảo toàn e: 3nNO = 2nCu + nAg → nNO = 0,015 (mol).
= 4nNO = 0,06 (mol) < 0,09 (mol).
2NO + O2 → 2NO2
0,015 0,0075 0,015 (mol)
Cho toàn bộ Y tác dụng với H2O:
4NO2 + O2 + 2H2O → 4HNO3 (tính theo )
0,015 0,015 (mol)
Câu 40:
Điện phân dung dịch X gồm CuSO4 và KCl (tỉ lệ mol tương ứng là 1: 5) với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi I = 2A. Sau 1930 giây, thu được dung dịch Y và hỗn hợp khí gồm H2 và Cl2 (có tỉ khối so với H2 là 24). Mặt khác, nếu điện phân X trong thời gian t giây thì khối lượng dung dịch giảm 2,715 gam. Giả thiết hiệu suất điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của t là
Đáp án đúng là: B
Quá trình điện phân:|
Catot (-): Cu2+, K+, H2O |
Anot (+): , Cl-, H2O |
|
Cu2+ + 2e Cu x 2x x (mol) 2H2O + 2e H2 + 2OH- (0,04-2x) (mol) |
2Cl- Cl2 + 2e 0,04 0,02 0,04 (mol) 2H2O O2 + 4H+ + 4e |
Số mol e trao đổi trong thời gian 1930 giây là:
ne(TĐ) = = 0,04 (mol).
Gọi = x (mol) → nKCl = 5x (mol).
ne(TĐ) = 2x + 2= 0,04 → = (0,02 – x) (mol).
Hỗn hợp khí gồm H2 và Cl2 có tỉ khối so với H2 là 24.
→ → x = 0,01.
Khi điện phân t giây:
|
Catot (-): Cu2+, K+, H2O |
Anot (+): , Cl-, H2O |
|
Cu2+ + 2e Cu 0,01 0,02 0,01 (mol) 2H2O + 2e H2 + 2OH- 2a 2a a |
2Cl- Cl2 + 2e 0,05 0,025 0,05 (mol) 2H2O O2 + 4H+ + 4e 2 b 4b |
Nếu điện phân hoàn toàn:
mCu + = 0,01×64 + 0,025×71 = 2,415 (gam) < 2,715 (gam).
Gọi số mol H2 và O2 sinh ra ở các điện cực lần lượt là a, b (mol).
Bảo toàn e: ne TĐ(-) = ne TĐ(+) → 0,02 + 2a = 0,05 + 4b (*).
mdd giảm = mCu + + +
Từ (*) và (**), suy ra: a = 0,03; b = 0,0075.
